Лабораторная работа № 1
Приборы и принадлежности: газовый вольтаметр, источник напряжения, амперметр, линейка, секундомер.
Для определения постоянной Больцмана можно использовать явление электролиза. При прохождении электрического тока через электролит (например, водный раствор кислоты) на электродах выделяются ионы этого электролита. В данной работе электролит представляет собой 15% водный раствор серной кислоты H2SO4, который заливается в прибор, получивший название вольтэлектрометра или вольтаметра. Рассмотрим основные процессы протекающие в электролите при прохождении тока. Молекулы воды обладают электрическим дипольным моментом, на который молекулы H2O4 оказывают ориентирующее действие. Создаваемое ориентированными дипольными моментами молекул воды электрическое поле оказывается столь большим, что молекулы H2SO4 распадаются на ионы:
H2SO4 = 2 H++SO4--
Этот процесс называется электролитической диссоциацией. Участвующие в тепловом движении ионы H+ и SO4-- могут сталкиваться друг с другом. При этом они могут объединяться в молекулы H2SO4. Этот процесс является обратным диссоциации и называется рекомбинацией. При равновесии число диссоциирующих и вновь возникающих молекул H2SO4 в среднем одинаково за любой не слишком малый промежуток времени.
Если в электролит опустить два электрода, находящихся под разным электрическим потенциалом, то электрическое поле вызовет движение ионов. Положительные ионы H+ начинают дрейфовать к электроду с меньшим потенциалом, то есть к катоду, а ионы SO4-- - в обратную сторону, то есть к аноду. Поэтому положительные ионы называются катионами, а отрицательные – анионами. Их упорядоченное движение и создает электрический ток. Особенностью его протекания являются сопутствующие ему химические превращения, происходящие на катоде и аноде.
На катоде: 2 H+ +2 е = H2
На аноде: SO4-- - 2е = O4.
В первом случае ионы H+ захватывают электроны на катоде. Во втором – ионы SO4— отдают электроны аноду.
Молекулярный водород выделяется вблизи катода в виде газовых пузырьков. Комплекс SO4 химически очень активен. Он вступает в химическую реакцию либо с растворителем, либо с веществом анода. Если электроды сделаны из платины или никеля, то молекулы SO4 реагируют только с растворителем, то есть с водой. При этом выделяется кислород:
SO4 + H2O = H2SO4 + 1/2 O2
Образующиеся в такой реакции молекулы H2SO4 поступают в раствор, а молекулярный кислород выделяется в виде газовых пузырьков на аноде.
Вольтаметр представляет собой U –образный сосуд, в каждое колено которого впаян электрод. Наверху каждая трубка для выпускания газов снабжена краном. Объем выделившегося газа определяется с помощью меток нанесенных на трубки. Наполнение прибора электролитом производится через особую трубку, которая в нижней части соединяется с U –образным сосудом, а в верхней части имеет шарообразное расширение. На подставке прибора имеются 2 клеммы, соединенные с электродами прибора и служащие для подключения его в цепь. При прохождении тока в катодном колене выделяется водород, состояние которого описывается уравнением Менделеева-Клапейрона
 PV=
PV= 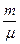 RT
RT
где Р – давление, V - объем, m – масса газа, 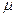 - масса моля, R - универсальная газовая постоянная, T - температура.
- масса моля, R - универсальная газовая постоянная, T - температура.
Учитывая, что m=Nm0, 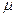 =NAm0 (где: m0 - масса одной молекулы воздуха, N - число молекул, NA - число Авогадро) получим
=NAm0 (где: m0 - масса одной молекулы воздуха, N - число молекул, NA - число Авогадро) получим
PV=NRT/NA=NkT (1)
k - постоянная Больцмана.
Уравнение (1) позволяет определить постоянную k
k=PV/NT (2)
Число молекул H2, выделившихся в катодном колене, можно найти по заряду Q, перенесенному ионами H+ за время протекания тока 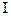
Q= 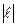
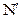
где 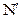 - число атомов водорода, образовавшихся на катоде за время t, e - заряд электрона.
- число атомов водорода, образовавшихся на катоде за время t, e - заряд электрона.
Атомы H быстро рекомбинируют, образуя молекулы H2, число которых в объеме V будет равно N= 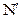 /2.
/2.
В экспериментах измеряется сила тока I и время t, в течение которого выделяется водород, занимающий объем V. Легко сообразить, что
N=I0t/2 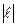 (3)
(3)
Учитывая (2) и (3), получим формулу
k=PV2 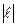 /ItT (4)
/ItT (4)
Число Лошмидта nL – это концентрация атомов при нормальных условиях (Т0=273 К, Р0=760 мм рт. ст.):
nL=N/V0 (5)
где V0 – объем, который занимал бы водород в катодном колене при Р=Р0 и Т=Т0.
Величину V0 можно найти согласно уравнению
PV/T=P0V0/T0 (6)
Учитывая (5) и (6), получим
nL=NTP0/PVT0 (7)
Проведение опыта:
Собрать электрическую цепь. Включить источник напряжения и установить электрический ток I 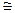 0.25+0.3A. Поддерживать его в течение всего опыта постоянным. Одновременно с включением тока пустить секундомер. Когда в катодном колене выделится 5-6 см3 газа, включить ток и остановить секундомер. Затем подождать пока все пузырьки газа выйдут из раствора, после этого можно сделать отсчет по нижнему краю мениска.
0.25+0.3A. Поддерживать его в течение всего опыта постоянным. Одновременно с включением тока пустить секундомер. Когда в катодном колене выделится 5-6 см3 газа, включить ток и остановить секундомер. Затем подождать пока все пузырьки газа выйдут из раствора, после этого можно сделать отсчет по нижнему краю мениска.
Провести измерение высоты h жидкости в среднем колене по отношению к высоте в катодном колене.
Опыт повторить 5 раз. После каждого измерения газ из вольтэлектрометра следует аккуратно выпустить в атмосферу.
Обработка результатов эксперимента.
Измерение объема выделившегося водорода и высоты h проводятся в 5 опытах, при этом время протекания тока следует четко выдерживать.
Необходимое для расчетов давление газа Р равно атмосферному, плюс давление столба жидкости поднявшейся в среднем колене и минус парциальное давление насыщенных паров воды над раствором серной кислоты. Если давление измеряется в мм рт. ст., то Р определяется соотношением
P=Pатм+ 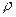 h/
h/ 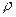 Hg – 0.88c (8)
Hg – 0.88c (8)
где 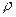 - плотность жидкости,
- плотность жидкости, 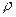 Hg – плотность ртути, с– давление насыщенных паров воды при температуре электролита.
Hg – плотность ртути, с– давление насыщенных паров воды при температуре электролита.
Используя формулы (4), (8) и (7), (8) определить постоянную Больцмана и число Лошмидта.
 2015-01-07
2015-01-07 762
762







