Реакции, протекание которых связано со смещением или полным переходом электронов от одних атомов или ионов к другим, называются окислительно-восстановительными. Число электронов, смещенных от атома (иона) данного элемента к атому (иону) данного элемента в соединении, называют степенью окисления. Степень окисления может быть положительной (электроны смещены от атома или иона) и отрицательной (электроны смещены к атому или иону).
Процесс отдачи электронов, т.е. повышения степени окисления элемента, называют окислением, а вещества отдающие электроны, восстановителями. К типичным восстановителям относятся простые вещества, атомы которых характеризуются невысокой электроотрицательностью (металлы, водород, углерод), некоторые анионы (CI-, S2-, SO32- и др.), катионы, у которых степень окисления может возрастать (Fe2+, Sn2+ и др.), некоторые соединения углерода (углеводороды, оксид углерода), азота (азотоводороды), бора (бороводороды) и др.
Процесс присоединения электронов, т.е. понижение степени окисления, называют восстановлением, а вещества, принимающие электроны, называют окислителями. К окислителям относятся простые вещества, атомы которых характеризуются высокой электроотрицательностью (элементы VI и VII групп главных подгрупп), катионы с высокой степенью окисления (Pb+4, Cr+6, Ge+4), анионы, в которых электроположительный элемент имеет высокую степень окисления (NO3-, Cr2O72-, MnO4 - и др.), высшие оксиды, а также пероксиды.
Окислительно-восстановительные реакции – это одновременно протекающие процессы окисления и восстановления. Реакции, в которых окислители и восстановители представляют собой разные вещества, называют межмолекулярными. Если окислителями и восстановителями служат атомы или ионы одной и той же молекулы, то такие реакции называют внутримолекулярными.
Направление окислительно-восстановительных реакций определяется вторым законом термодинамики. Если процесс протекает при изобарно-изотермических условиях, то прямая реакция возможна при условии, что энергия Гиббса ее ниже нуля: 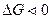 .
.
Окислительно-восстановительную способность вещества определяет окислительно-восстановительный потенциал реакции (редокс-потенциал) окислительная способность веществ тем выше, чем больше положительное значение окислительно-восстановительного потенциала реакции.
В общем виде обратимую реакцию окисления-восстановления можно записать уравнением
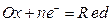
где Ox – окисленная форма веществ; Red – восстановленная форма веществ. Уравнение окислительно-восстановительного потенциала (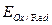 ) для этой реакции имеет вид
) для этой реакции имеет вид
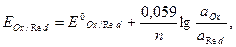
где 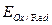 – стандартный окислительно-восстановительный потенциал;
– стандартный окислительно-восстановительный потенциал;
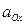 ,
, 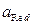 – активности соответственно окисленной и восстановленной форм веществ.
– активности соответственно окисленной и восстановленной форм веществ.
В случае, если в окислительно-восстановительных реакциях участвуют ионы водорода или гидроксида, потенциалы этих реакций зависят от pH, например, для реакции
NO3- + 3H+ + 2e- = HNO2 + H2O
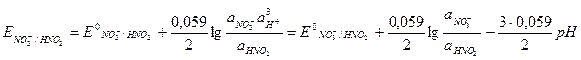
 2015-01-07
2015-01-07 620
620








