1. Физические свойства бензола
а) определение температуры кипения бензола.
В пробирки налить 2-3 мл бензола, опустить её в нагретую до кипения воду и довести бензол до кипения. Температура его кипения при этом меньше 100 оС. Полу8ченный результат сравнить с табличными данными.
б) определение плотности бензола.
В пробирку наливают 4 мл бензола и 2-3 мл воды. Что наблюдается? Сделать вывод.
2. Бензол как растворитель
В 4 пробирки наливают по 1-2 мл бензола. В первую пробирку наливают воду, во вторую – масло, в третью - керосин (по 1 мл каждого), в четвертую пробирку бросают несколько кусочков серы. Содержимое пробирок встряхивают. Что наблюдается?
Сделать выводы.
3. Отношение бензола к окислителям
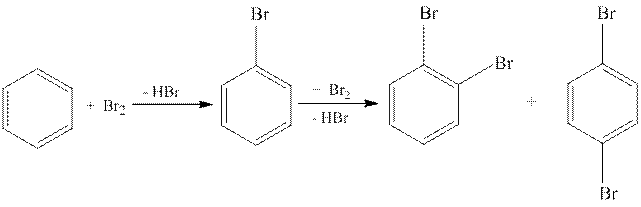
3.1. Отношение бензола к брому.
а) В пробирке встряхивают смесь, состоящую из 2 мл бензола и 1-2 мл бромной воды. Окраска брома не исчезает, т.к. бром при обычных условиях не взаимодействует с бензолом, но переходит из воды в бензол, при этом верхний слой, содержащий бензол, окрашивается в желто-бурый цвет после растворения в нем брома.
б) Присутствие катализаторов способствует реакции замещения атомов водорода в ядре бензола.
В пробирку к 1-2 мл бензола прибавляют 1-2 мл раствора брома в четыреххлористом углероде и 0,5 г железных опилок в качестве катализатора. Смесь нагревают в водяной бане. Пары образовавшегося бромоводорода можно обнаружить по изменению цвета влажной синей лакмусовой бумажки, поднесенной к отверстию пробирки:
3.2. Отношение бензола к раствору перманганата калия.
В пробирку внести 2-3 мл бензола и 2 мл подкисленного раствора перманганата калия. Изменения окраски раствора перманганата калия не происходит даже при нагревании, что указывает на устойчивость бензольного ядра к окислителям.
4. Окисление гомологов бензола.
В одну пробирку наливают 2-3 мл толуола, во вторую столько же орто-ксилола. В каждую добавляют по 2 мл подкисленного раствора перманганата калия. При встряхивании и осторожном нагревании окраска растворов изменяется и выделяется нерастворимый бурый осадок оксида марганца (IV).
Толуол окисляется до бензойной кислоты:
|
|

Орто-ксилол образует фталевую кислоту:
|
|

5. Сульфирование бензола и его гомологов.
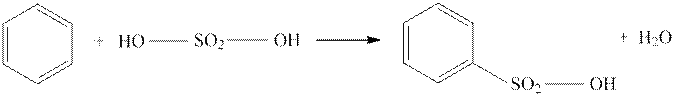
а)Образование бензолсульфокислоты.
В пробирку с воздушным холодильником (рис. 2) вносят 3 мл дымящей серной кислоты и далее, по каплям, при постоянном взбалтывании прибавляют 2 мл бензола. При этом происходит разогревание смеси, и бензол постепенно растворяется. Реакционную смесь осторожно подогревают на водяной бане. По охлаждении раствор выливают в заранее подготовленный стеклянный стакан, содержащий 30—40 мл насыщенного раствора поваренной соли. При этом образуется кристаллический осадок натриевой соли бензолсульфокислоты:

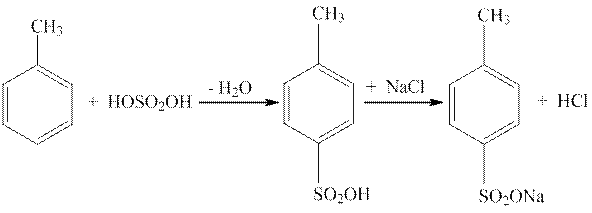
б) Образование толуолсульфокислоты.
В пробирку с воздушным холодильником, содержащую 1 мл толуола, добавляют 3 мл концентрированной серной кислоты. Реакция протекает с выделением тепла и толуол постепенно растворяется в серной кислоте.




Рис. 2. Прибор для сульфирования бензола и толуола
Для окончания реакции смесь осторожно нагревают на водяной бане в течение 10—15 минут, время от времени осторожно встряхивая содержимое пробирки. Нагревание заканчивают, когда жидкость станет однородной. Охлажденную реакционную смесь выливают в стеклянный стаканчик, содержащий 10—15 мл насыщенного раствора поваренной соли. Из охлажденного раствора выпадают кристаллы натриевой соли пара-толуолсульфокислоты с примесью орто-изомера:
6. Качественная реакция на ароматические углеводороды (формалитовая реакция,
реакция Настюкова).
а) На стеклянную пластинку нанести одну каплю формалина, 3 капли концентрированной серной кислоты и одну каплю бензола.
 2015-01-07
2015-01-07 1560
1560








