Состояние воды исследовано в широком интервале температур и давлений. Известно, что при высоких давлениях лёд может находиться в различных кристаллических модификациях, в зависимости от физических условий (Р и Т). Это явление, названное полиморфизмом, присуще и многим другим веществам. Мы рассмотрим диаграмму состояния воды при невысоких давлениях (до 2000 атм).
Диаграмма имеет три поля фаз (рис. 4.1):
1) АОВ - поле жидкости,
2) ВОС (под кривой) - поле ненасыщенного пара,
3) АОС - поле твердой фазы.
|

В любой точке поля система однофазна и бивариантна (К = 1; Ф = 1; С = 2), т.е. в определенных пределах можно менять температуру и давление без изменения количества фаз и их природы. Например, точка 1 соответствует жидкой воде, которая имеет параметры t°1 и Р1.
Если в системе в равновесии находятся две фазы, то К = 1; Ф = 2; С = 1, т.е. система моновариантна. Это значит, что один параметр можно изменять произвольно в некоторых пределах, а другой должен изменяться в зависимости от первого. Эта зависимость выражается кривой Р = f(Т): ОВ - кривая испарения (или конденсации); ОС - кривая возгонки (или сублимации); АО - кривая плавления (или затвердевания). Например, точка 2 характеризует равновесную систему, в которой при температуре t°2 и давлении Р2 находятся в равновесии вода и насыщенный водяной пар. Если Р2 = 1 атм, то t°2 называется нормальной температурой кипения.
Кривая испарения воды ОВ обрывается в критической точке (В) при t° = 374°С и Р = 218 атм. Выше этой точки жидкая и парообразная вода не различимы по свойствам. Это установлено Д.И. Менделеевым в 1860 г.
Кривая плавления льда АО при давлениях до 2047 атм имеет левый наклон, что соответствует условию DVф.п. < 0 (мольный объем льда > мольного объема воды). Такой лед легче воды, он плавает на воде, поэтому в природных водоемах, не промерзающих до дна, сохраняются живые организмы. При более высоких давлениях лед переходит в более плотные модификации, тогда кривая плавления АО наклонена вправо. Известно семь кристаллических модификаций льда, из них шесть имеют плотность выше плотности жидкой воды. Последняя из них появляется при давлении 21680 атм. Превращение одной формы льда в другую является энантиотропным переходом (см. далее о полиморфизме).
Пунктирная кривая ОD (продолжение ОВ) характеризует метастабильное равновесие: переохлажденная вода ↔ насыщенный пар.
Метастабильныминазываются равновесия, при которых имеются все внешние признаки равновесия фаз, но изобарный потенциал системы не достиг минимального абсолютного значения и может уменьшаться далее. Вода, кристаллизуясь на примесях, перейдет в лед. Точка О - тройная точка. Ее координаты для воды в отсутствие воздуха: Р = 4,579 мм рт. ст., t° = 0,01°C. В присутствии воздуха при 1 атм три фазы находятся в равновесии при 0ºС. В этом случае общее давление равно 1 атм, но парциальное давление водяного пара составляет 4,579 мм рт. ст. Понижение температуры замерзания при этом на 0,01º вызвано двумя причинами: растворимостью воздуха в воде (см. раздел «понижение температуры замерзания растворов») и влиянием общего давления на температуру замерзания жидкостей (повышение общего давления в системе понижает её). Это единственная точка, в которой в равновесии находятся все три фазы: вода, лед и пар. В этой точке система инвариантна: С = 0.
4.5.2. Полиморфизм
Кристаллическая структура вещества определяется не только его химическим составом, но и условиями образования. В природе существует множество примеров, когда в зависимости от условий образования, вещества могут иметь различную структуру кристаллов, т.е. тип решетки, и поэтому различные физические свойства. Это явление называется полиморфизмом. Присутствие той или иной модификации вещества может таким образом характеризовать условия его образования. Полиморфные модификации обозначают греческими буквами a, b, g, d.
Возможны два типа полиморфизма: энантиотропный и монотропный.
Энантиотропия характеризуется обратимым самопроизвольным переходом при определенных Р и Т одной формы в другую. Этот переход сопровождается снижением энергии Гиббса при изменении термодинамических условий (Р,Т). На рис. 4.2 показан энантиотропный переход от фазы a к фазе b при (Р,Т)a↔b. До температуры и давления фазового перехода (левее точки (Р,Т)a↔b) более устойчива a-модификация вещества, т.к. она обладает меньшим запасом свободной энергии G. В точке пересечения кривых Ga=Gb, обе фазы находятся в равновесии. За этой точкой, т.е. при высоких Р и Т, устойчивее b-фаза. Таким образом, a-фаза является низкотемпературной, а b - высокотемпературной модификацией вещества.
|
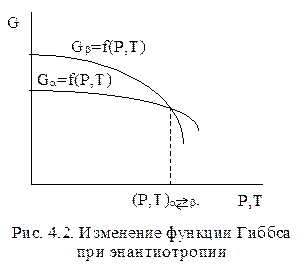
Энантиотропные превращения характерны для углерода, серы, двуокиси кремния и многих других веществ.
Если во всем интервале Р и Т стабильна только одна фаза, то фазовый переход не связан с определенными значениями Р и Т и является необратимым. Такой тип полиморфизма называется монотропией (рис.4.3). Более стабильна та фаза, энергия Гиббса которой ниже (на рис. 4.3. фаза a). Монотропные формы в природных условиях встречаются реже; примером может служить система
gFe2O3 ® aFe2O3
маггемит гематит
|
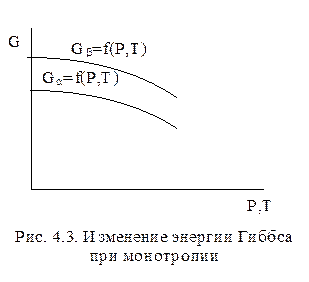
На фазовой диаграмме полиморфизм вещества характеризуется дополнительными линиями, ограничивающими области существования отдельных полиморфных модификаций.
 2014-05-17
2014-05-17 4555
4555








