Раствором называют гомогенную систему, состоящую из двух или более веществ, содержание которых можно изменять в определенных пределах 6ез нарушения однородности.
Для количественной характеристики растворов используют понятие Концентрации.
Концентрация - величина, выражающая относительное содержание данного компонента в системе (смеси, растворе).
Из концентраций растворов наибольшее применение в химии находят следующие:
Процентная концентрация растворов показывает число единиц массы растворенного вещества, содержащееся в 100 единицах массы раствора.
Так, 12% раствор 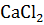 содержит 12 единиц массы
содержит 12 единиц массы 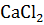 в 100 единицах массы раствора и для его приготовления следует взять 12 единиц массы
в 100 единицах массы раствора и для его приготовления следует взять 12 единиц массы 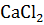 и 88 единиц массы растворителя.
и 88 единиц массы растворителя.
Молярная концентрация раствора (молярность) - отношение количества этого вещества, содержащегося в растворе (в молях), к объему раствора:
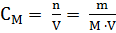 ; Единица СИ – моль
; Единица СИ – моль 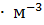 , обычно применяют моль
, обычно применяют моль 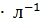 ,
,
где m - масса растворенного вещества, г;
М - молярная масса растворенного вещества, г 
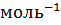 ;
;
V - объем раствора, л.
Молярным называется раствор, в 1 л которого содержится 1 моль растворенного вещества.
Эквивалентная (нормальная) концентрация раствора (нормальность) – отношение числа эквивалентов вещества, содержащегося в растворе, к объему раствора:
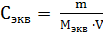 ,
,
где m - масса растворенного вещества;
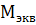 - молярная масса эквивалента растворенного вещества. Единица эквивалентной концентрации в СИ - моль
- молярная масса эквивалента растворенного вещества. Единица эквивалентной концентрации в СИ - моль 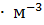 обычно применяют моль
обычно применяют моль 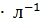 .
.
Моляльная концентрация раствора (моляльностъ) определяется числом нолей растворенного вещества в 1 кг (1000 г) растворителя. Единица моляльности раствора в СИ - моль • 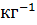 , можно применять моль •
, можно применять моль • 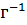 ,.
,.
Основная особенность моляльного способа выражения концентрации заключается в том, что моляльная концентрация раствора не зависит от температуры, поскольку для определения моляльности не привлекается объем.
Массовой долей растворенного вещества называют отношение массы растворенного вещества к обшей массе раствора. Массовую долю обычно выражают в долях единицы и обозначают W.
Мольная доля - отношение числа молей данного вещества в растворе к общему числу молей веществ, образующих раствор.
Для приготовления растворов заданных концентраций должны проводиться соответствующие расчеты [1].
 2015-01-13
2015-01-13 494
494








