1. Как отразится повышение давления на равновесии системы
ВаО + 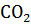

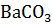 -
- 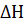 ? Как следует изменить температуру, чтобы равновесие сместилось влево? Написать выражение для константы равновесия.
? Как следует изменить температуру, чтобы равновесие сместилось влево? Написать выражение для константы равновесия.
2. Определить температуру, при которой константа равновесия реакции
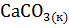

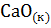 +
+ 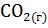 равна 1.
равна 1.
3. По величине 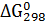 образования сульфата и карбоната магния определить, какая из этих солей более устойчива. Вычислить температуры термической диссоциации этих солей, если константы равновесия принять равный 1.
образования сульфата и карбоната магния определить, какая из этих солей более устойчива. Вычислить температуры термической диссоциации этих солей, если константы равновесия принять равный 1.
4. Константа равновесия системы 2NO + 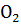
 2
2 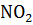 найдена равной 1,21. Равновесные концентрации: [
найдена равной 1,21. Равновесные концентрации: [ 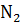 ] = 0,72 и [
] = 0,72 и [ 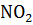 ] = 0,84 моль
] = 0,84 моль 
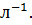 Найти первоначальную и равновесную концентрацию кислорода.
Найти первоначальную и равновесную концентрацию кислорода.
5. Константа равновесия реакции 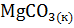

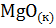 +
+ 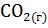 при 676
при 676 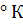 равна 1. Найти константу равновесия указанной реакции при 924
равна 1. Найти константу равновесия указанной реакции при 924  К, если среднее изменение энтальпии
К, если среднее изменение энтальпии 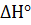 в этом интервале температур составляет 28,6 ккал.
в этом интервале температур составляет 28,6 ккал.
6. Как надо поступить, чтобы при данной концентрации исходных веществ максимально повысить выход 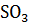 по реакции
по реакции
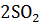 +
+ 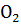

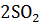 + 45 ккал?
+ 45 ккал?
7. Константа диссоциации угольной кислоты по первой стадии при 0 и 50  С равна 2,95
С равна 2,95 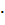
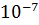 и 4,9
и 4,9 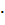
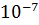 соответственно. Определите термодинамические характеристики в интервале 0 - 50
соответственно. Определите термодинамические характеристики в интервале 0 - 50 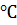 для диссоциации угольной кислоты по уравнению
для диссоциации угольной кислоты по уравнению 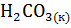
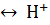 +
+ 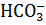 .
.
8. Куда сместится равновесия в системе 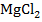 +
+ 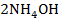
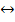
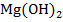 +
+ 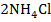 при добавлении концентрированного раствора хлорида аммония, т.е. будет ли
при добавлении концентрированного раствора хлорида аммония, т.е. будет ли 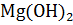 растворяться или осадок будет увеличиваться?
растворяться или осадок будет увеличиваться?
9. Рассчитать термодинамические характеристики процесса диссоциации карбоната на оксид кальция и углекислый газ при стандартной температуре.
10. При некоторой температуре константа равновесия термической диссоциации 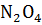

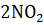 равна 0,16. Равновесная концентрация
равна 0,16. Равновесная концентрация 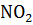 равна 0,08 моль
равна 0,08 моль 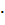
 . Вычислить равновесную и первоначальную концентрацию
. Вычислить равновесную и первоначальную концентрацию 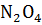 . Сколько процентов этого вещества диссоциировало?
. Сколько процентов этого вещества диссоциировало?
11. Какими изменениями концентраций можно направить в обратную сторону процесс 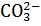 +
+ 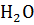

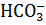 +
+ 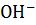 ?
?
12. Константа равновесия гомогенной системы
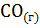 +
+ 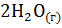

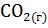 +
+ 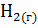 при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации [CO] = 0,1 моль
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации [CO] = 0,1 моль 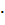
 ; [
; [ 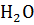 ] = 0,4 моль
] = 0,4 моль 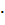
 .
.
13. Куда сместится равновесие в системе
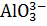 +
+ 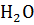

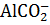 +
+ 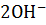 :
:
а) при разбавлении раствора;
б) при прибавлении щелочи;
в) при прибавлении кислоты?
14. Скорость образования иодида водорода из водорода и йода при температуре 450 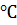 в момент, когда [
в момент, когда [ 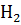 ] = [
] = [ 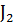 ] = 1 составляет 2
] = 1 составляет 2 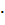
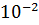 моль
моль 
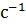 . Скорость распада иодида водорода при той же температуре и при [HJ] = 1 равна 4
. Скорость распада иодида водорода при той же температуре и при [HJ] = 1 равна 4 
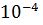 моль
моль 
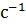 . Вычислить константу равновесия реакции разложения иодида водорода при этой же температуре.
. Вычислить константу равновесия реакции разложения иодида водорода при этой же температуре.
15. При какой температуре константа равновесия реакции 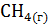 +
+ 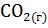

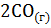 +
+ 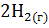 равна 1?
равна 1?
16. Почему при изменении давления смещается равновесие реакции
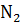 +
+ 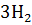

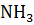 и не смещается равновесие
и не смещается равновесие 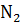 +
+ 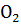
 2NO?
2NO?
17. Реакции СО + 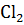

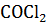 протекает в объеме 10л. Состав равновесной смеси: 14 г СО; 35,5 г
протекает в объеме 10л. Состав равновесной смеси: 14 г СО; 35,5 г 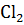 и 49,5 г
и 49,5 г 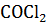 . Вычислить константу равновесия реакции.
. Вычислить константу равновесия реакции.
18. Равновесные концентрации веществ в обратимой реакции
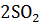 +
+ 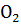

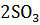 составляют (моль
составляют (моль 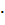
 ):
):
[ 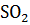 ] = 0.002; [
] = 0.002; [ 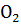 ] = 0.004; [
] = 0.004; [ 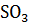 ] = 0.003.
] = 0.003.
Вычислить исходные концентрации кислорода и оксида серы (IV). Вычислить константу равновесия.
19. В сосуд объемом 0,5 л помещено 0,5 моля кислорода и 0,5 моля азота. К моменту равновесия образовалось 0,02 моля аммиака. Вычислить константу равновесия.
20. Определите температуру, для которой константа равновесия реакции термического разложения 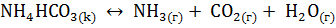 равна 1.
равна 1.
21. Как изменится равновесие системы
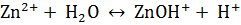
а) при добавлении кислоты;
б) при добавлении щелочи?
22. Константа нестойкости иона 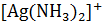 при 25
при 25 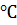 равна
равна
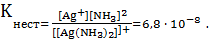
Вычислить 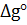 процесса
процесса 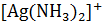

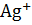 + 2
+ 2 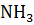 и сделать вывод о реакции, которая самопроизвольно может протекать в растворе, содержащем эти ионы и аммиак при стандартных условиях.
и сделать вывод о реакции, которая самопроизвольно может протекать в растворе, содержащем эти ионы и аммиак при стандартных условиях.
23. Вычислить константу равновесия реакции 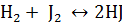 , происходящей в сосуде объемом 2 л, если первоначальные количества веществ были следующие: 0.2 г
, происходящей в сосуде объемом 2 л, если первоначальные количества веществ были следующие: 0.2 г 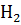 ; 0,12 г
; 0,12 г 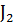 и к моменту равновесия прореагировало 20% водорода.
и к моменту равновесия прореагировало 20% водорода.
24. Рассчитать температуру, для которой константа равновесия реакции термического разложения нитрата меди равна 1. Чему равна константа равновесия этой реакции при 550  К?
К?
25. Вычислить равновесные концентрации веществ в обратимой реакции
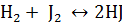 , если начальная концентрация водорода равна 1 моль
, если начальная концентрация водорода равна 1 моль 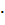
 , а йода – 0,6 моль
, а йода – 0,6 моль 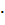
 и известно, что в реакцию вступило 50% водорода.
и известно, что в реакцию вступило 50% водорода.
Вычислить константу равновесия реакции.
 2015-01-13
2015-01-13 1233
1233
