Авогадро число NA (постоянная Лошмидта) – природная константа, указывающая число молекул в одном моле вещества. (NA = 6,023∙1023 моль-1)
Аккумуляторы электрические – гальванические элементы, предназначенные для многократного использования. Наиболее распространены А – свинцовые Рb|H2SO4|PbO2|Pb, железо-никелевые Fe|KOH|NiOOH|Ni и кадмий-никелевые Cd|KOH|NiOOH|Ni
Активация – сообщение частицам такого количества энергии, что при их эффективном соударении происходит разрыхление связей и образование веществ в активированном состоянии.
Анионы – отрицательно заряженные ионы.
Атом – наименьшая частица химического элемента, являющаяся носителем его свойств. Это электронейтральная микросистема, подчиняющаяся квантовым законам.
Адсорбция – концентрирование вещества (адсорбата) из объема фаз на поверхности раздела между ними, например из газа или раствора на поверхности или в объеме микропор твердого тела (адсорбента).
Азотистая кислота – HNO2. Существует только в разбавленных водных растворах.
Азотистая кислота – НNО3 с водой смешивается во всех отношениях. Сильная одноосновная кислота.
Алебастр (жженый гипс) – 2CaSO4∙H2O. Получают из гипса (CaSO4∙2H2O) при нагревании его до 150-1700С, при этом гипс теряет ¾ содержащейся в нем кристаллизационной воды, образуя алебастр.
Алюминаты – соли неустойчивых алюминевых кислот – ортоалюминиевой H3AlO3 и метаалюминиевой HAlO2 и др. Обладают высокой химической и термической стойкостью.
Алюмосиликаты – силикаты, содержащие алюминий. Самыми важными являются полевые шпаты. Обычный полевой шпат (ортоклаз) имеет формулу К2О∙Al2O3∙6SiO2
Ангидрит – безводный сульфат кальция (тех).
Апатит – минерал, содержащий Са3(РО4)2, СаF2 или СаСl2.
Асбест – собирательное название группы природных гидросиликатов, способных при механическом воздействии расщепляться на гибкие, тонкие (до 0,5мкм) волокна. Обладает огнестойкостью, щелочностойкостью, адсорбционной активностью и т.д. Образует устойчивые композиции с цементом, битумом, асфальтом, органическими соединениями.
Аэрозоли – дисперсные системы, состоящие из мелких частиц, взвешенных в воздухе или другом газе.
Бетон – строительный материал, получаемый при смешивании цементного растора с гравием или щебнем. Сооружения из бетона с основой из железных балок или стержней называются железобетонными.
Битумы – состоят из асфальтенов (высокомолекулярные компоненты нефти), асфальтовых кислот, их ангидридов, смол и масел.
Битумные пластики – термопластичные материалы на основе природных и искусственных битумов, каменного угля, пека или их сплавов.
Валентность – способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Водородный показатель (рН) – это отрицательный десятичный логарифм концентрации ионов водорода (рН = - lg[Н+]. Определяет кислотность или щелочность среды.
Водяной газ – смесь газов, получаемая газификацией твердых или жидких топлив под действием водяного пара (С+Н2О→СО+Н2 – 136,9 мДж/моль). Примерный состав водяного газа из каменного угля (в % по объему): 56,5 СО; 31,2 Н2; 10,0 СО2; 1,6N2; 0,6(Н2S+СОS); 0,1СН4.
Воздушный газ - смесь газов (до 65% по объему N2 и до 33% СО), получаемая газификацией природного топлива или кокса, с использованием воздуха в качестве окислителя.
Вяжущие материалы – неорганические тонкодисперсные вещества, образующие при смешивании с водой или водными растворами солей (магнезиальные вяжущие) или кислот (фосфатные вяжущие) пластичную массу, со временем затвердевающую в прочное камневидное тело.
Газовая постоянная (R) = 8,314 Дж/(моль∙К).
Гальванические элементы – химические источники тока, состоящие из одной гальванической ячейки. В состав такой ячейки входит ионопроводящий электролит, два разнородных электрода и реагенты.
Гальванотехника – нанесение металлических слоев на поверхность изделий методом электроосаждения. Включает гальваностегию и гальванопластику. Гальваностегию используют для защиты изделий от коррозии, повышения их износостойкости, электропроводности и т.д. Гальванопластика позволяет получать копии, воспроизводящие мельчайшие подробности рисунка или рельефа поверхности.
Гелеобразование (желатинирование, застудневание) – переход жидкостей (дисперсных систем, растворов, расплавов) в твердообразное состояние – гель или студень.
Гели – структурированные коллоидные системы с жидкой дисперсной средой.
Гидратация – взаимодействие веществ с водой, при котором молекулы не разрушаются (в отличие от гидролиза и других реакций с участием воды), частный случай сольватации.
Гидриды – соединения водорода с металлами или менее электроотрицательными, чем водород неметаллами.
Гидролиз – обменная реакция между веществом и водой. При гидролизе солей образуются кислоты и основания.
Гипс строительный (алебастр) – вяжущий материал воздушного твердения. Основное сырье – гипсовый камень CaSO4∙2H2O. Иногда используют отходы производства Н3РО4, НF или В, содержащие CaSO4∙2H2O с примесями фосфатных солей Са, плавикового шпата или Н3ВО4 (соответственно фосфогипс, фторогипс, борогипс).
Глинозем – оксид алюминия (Al2O3).
Графит – модификация углерода, кристаллизующегося в гексагональной слоистой структуре. Встречается в природе. Получается нагреванием смеси кокса и пека до 28000, из газообразных углеводородов и т.д.
Гремучий газ – смесь Н2 и О2 (обычно при соотношении по объему 2:1). Взрывается при соприкосновении с огнем или под действием электрической искры.
Дальтона законы: 1. Общее давление смеси газов, химически не взаимодействующих между собой, равно сумме их парциальных давлений. 2. Растворимость каждого из компонентов газовой смеси в данной жидкости при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности другого компонента.
Дейтерий – (тяжелый водород) D, стабильный изотоп водорода, массовое число 2, атомная масса 2,014. Молекула двухатомная.
Диаграмма состояния – (фазовая диаграмма), графическое изображение всех возможных фазовых состояний термодинамической системы в пространстве основных параметров состояния – температуры, давления, объема и состава.
Доломит – MgCO3∙CaCO3.
Жесткость воды – совокупность свойств воды, обусловленная наличием в ней катионов Са2+ и Mg2+. Сумма их концентраций, выраженная в ммоль/л или ммоль/кг, называется общей жесткостью.
Законы:
- Авогадро: в равных объемах любых газов, взятых при одинаковых температурах и давлениях, содержится одно и тоже число молекул.
- Вант-Гоффа: осмотическое давление зависит от температуры (Т) и молекулярной концентрации (См), т.е. Росм=СмRT.
- Гесса: тепловой эффект реакции зависит от начального и конечного состояния вещества и не зависит от промежуточных стадий процесса.
- действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
- периодический Д.И. Менделеева: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
- разбавление (Оствальда): 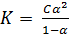 , где К – константа скорости реакции; С – молярная концентрация (моль/л); α – степень диссоциации (доли единицы).
, где К – константа скорости реакции; С – молярная концентрация (моль/л); α – степень диссоциации (доли единицы).
- Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (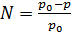 , где N – мольная доля растворенного вещества).
, где N – мольная доля растворенного вещества).
- эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных эквивалентным массам (объемам).
- электролиза: масса образующегося при электролизе вещества, пропорциональна количеству электричества и электрохимическому эквиваленту данного вещества (m = A∙Q или 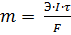 , где m – масса вещества; А – электрохимический эквивалент вещества А = Э/F; Q – количество электричества, кл; I – сила тока, А; τ – время, с; F – число Фарадея = 96500 кл (эквивалент электричества); Э – молярная масса эквивалент вещества, г/моль.)
, где m – масса вещества; А – электрохимический эквивалент вещества А = Э/F; Q – количество электричества, кл; I – сила тока, А; τ – время, с; F – число Фарадея = 96500 кл (эквивалент электричества); Э – молярная масса эквивалент вещества, г/моль.)
Золи – коллоидные системы с жидкой дисперсной средой.
Известь – вяжущий материал воздушного или гидравлического твердения. Получается обжигом кусковых известково-магнезиальных карбонатных горных пород (известняка, мела и т.д.) при 1000-12000С. Воздушная известь состоит в основном из СаО и MgО. Негашеная известь – СаО; гашеная известь – Са(ОН)2. Гашение, т.е. взаимодействие СаО с водой происходит с выделением тепла. В зависимости от объема воды образуется известь пушенка или известковое молоко.
Известняк – в основном СаСО3.
Изотопы – атомы, обладающие одинаковым зарядом ядра (и следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом).
Иониты – (ионнообменники, ионнообменные сорбенты), вещества, способные к ионному обмену при контакте с растворами электролитов. По знаку заряда обменивающихся ионов иониты делят на катиониты, аниониты и амфолиты. Иониты могут быть природными (цеолиты, целлюлозы, древесина, торф) и синтетическими (силикагель, Al2O3, сульфоуголь и ионнообменные смолы).
Коррозия металлов – физико-химическое взаимодействие металла со средой, ведущее к разрушению металла.
Кремнезем – диоксид кремния SiO2 (кремниевый ангидрид).
Криолит – Na3AlF6.
Латуни – сплавы Cu с Zn (до 50%).
Лиофильность и лиофобность – термины, характеризующие способности вещества (тела) взаимодействовать с жидкой средой. Лиофильные вещества растворимы в данной жидкости, смачиваются или набухают. Лиофобные вещества не набухают, поверхность лиофобных тел не смачивается.
Массовая доля (W) – способ выражения концентрации, показывающий отношение массы вещества (mв-ва) к массе всего раствора (mр-ра); выражается в долях единицы (W = mв-ва / mр-ра) или процентах (W∙100).
Моль – количество вещества, содержащее столько же структурных элементов, сколько содержится атомов в 0,012 кг углерода.
Мольная масса – масса 1 моля данного вещества; мольная масса вещества, выраженная в граммах, имеет то же численное значение, что и его относительная молекулярная атомная масса), выраженная в а.е.м.
Мольная доля (Х) – способ выражения концентрации, выражающий отношение числа молей данного вещества (n) к общему числу молей всех веществ, имеющихся в растворе (Х= 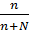 , где N – число моль растворителя).
, где N – число моль растворителя).
Мольный объем газа – 22,4 л при нормальных условиях (н.у.)
Молярность (См) – способ выражения концентрации раствора, показывающий число моль вещества в литре раствора (См = 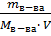 , где mв-ва – масса вещества, г; Мв-ва – молярная масса вещества, г/моль; V – объем раствора,л)
, где mв-ва – масса вещества, г; Мв-ва – молярная масса вещества, г/моль; V – объем раствора,л)
Моляльность (Сm) – способ выражения концентрации, показывающий число моль вещества в 1 кг растворителя (Сm = 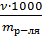 , где 𝜈 – количество вещества, моль; mр-ля – масса растворителя, г).
, где 𝜈 – количество вещества, моль; mр-ля – масса растворителя, г).
Мрамор – природная разновидность карбоната кальция (СаСО3).
Нормальность растворов – эквивалентная концентрация (Сэкв, Н, N), показывает число эквивалентов данного вещества в 1 литре раствора.
Обессоливание воды – обработка воды, в результате которой вода освобождается от катионов и анионов. Обычно это достигается применением ионнообменных материалов.
Окислительно-восстановительные реакции – сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, в результате перемещения электронов от атома одного из реагентов (восстановителя) к атому другого (окислителя).
Осмос – самопроизвольный переход вещества через полупроницаемую мембрану, разделяющую два раствора различных концентраций или чистый растворитель и раствор.
Парциальное давление – давление, которое производило бы имеющееся в смеси количество данного газа, если бы оно занимало при той же температуре весь объем системы.
Пены – ячеистые структурированные дисперсные системы, образованные скоплением пузырей газа (пара), разделенных тонкими прослойками жидкости.
Поверхностно-активные вещества – (ПАВ), концентрируются на поверхности раздела фаз, вызывая снижение поверхностного (межфазного) натяжения. Типичные ПАВ – это органические соединения, молекулы которых лиофильные и лиофобные атомные группы (обычно гидрофильные и гидрофобные).
Принцип Ле Шателье – если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Произведение растворимости – величина, количественно характеризующая способность электролита растворяться; в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре; эта величина называется произведением растворимости электролита (ПР).
Растворимость – способность вещества образовывать с другими веществами растворы. Количественно характеризуется концентрацией насыщенного раствора данного вещества в данном растворителе.
Седиментация – направленное движение частиц в поле действия гравитационных или центробежных сил.
Силитры – нитраты Na, К, NH4+, Са, Ва. Натриевая (наиболее растворенная) и калиевая селитры встречаются в виде природных залежей.
Силикаты – соли кремниевых кислот. Различают мета-, орто-, дисиликаты и др.
Сода – Na2CO3.
Сольватация – взаимодействие растворенных частиц с молекулами растворителя.
Сорбция – поглощение твердым телом или жидкостью вещества из окружающей среды.
Стехиометрия – соотношение между количеством вступающих в реакцию реагентов и образующихся реагентов.
Сублимация – (возгонка), переход вещества из твердого состояния (непосредственно без плавления) в газообразное.
Тепловой эффект реакции – теплота, выделенная (экзотермический процесс) или поглощенная (эндотермический процесс) термодинамической системой при протекании в ней химической реакции, при условии, что данная система не совершает никакой работы, кроме работы растирания, а температура продуктов реакции равна температуре исходных веществ.
Теплота образования – (стандартная энтальпия образования), тепловой эффект образования соединений из простых веществ в их стандартных соотношениях.
Термохимия – раздел химической термодинамики, включающий определение тепловых эффектов реакций и установление их зависимостей от различных физико-химических параметров.
Тиксотропия – обратимое изменение физико-механических свойств полимерных и дисперсных систем при механическом воздействии в изотермических условиях.
Тяжелая вода – (оксид дейтерия) D2О, изотопная разновидность воды, молекулы которой вместо атомов 1Н содержат атомы дейтерия; tпл = 3,8130С; tкип=101,430С.
Фаза – однородная часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства веществ меняются скачкообразно.
Электролиз – совокупность окислительно-восстановительных реакций, протекающих на электродах при пропускании электрического тока через расплав или раствор электролита.
Энтальпия – (теплосодержание) функция состояния термодинамической системы Н = U+pυ, где U – внутренняя энергия, р – давление, υ – объем.
Энтропия – функция состояния термодинамической системы. S = KlnW, где k – константа Больцмана, W – термодинамическая вероятность данного состояния системы.
Ядро атомное – центральная часть атома, в которой сосредоточена основная часть его массы.
Приложение 1
Произведение растворимости малорастворимых веществ в воде при 25оС
| Вещество | ПР |
| AgBr | 6,3∙10-13 |
| Ag2CO3 | 6,15∙10-12 |
| AgCl | 1,56∙10-10 |
| AgI | 1,5∙10-16 |
| Ag3PO4 (20oC) | 1,8∙10-18 |
| Ag2S | 5,7∙10-51 |
| Ag2SO4 | 7,7∙10-5 |
| Al(OH)3 | 1,9∙10-33 |
| BaCO3 | 7∙10-9 |
| BaCrO4 | 2,3∙10-10 |
| BaSO4 | 1,08∙10-10 |
| CaCO3 | 4,8∙10-9 |
| Ca3(PO4)3 | 1∙10-25 |
| CaSO4 | 6,10∙10-5 |
| CdCO3 | 2,5∙10-14 |
| CuCO3 | 2,36∙10-10 |
| Cu(OH)2 | 5,6∙10-20 |
| CuS | 4, ∙10-38 |
| Fe(OH)3 (18oC) | 3,8∙10-38 |
| FeS | 3,7∙10-19 |
| Mg(OH)2 | 5,5∙10-12 |
| MgS | 2,0∙10-15 |
| MnCO3 | 5,05∙10-10 |
| MnS (18oC) | 5,6∙10-16 |
| PbCO3 | 1,5∙10-13 |
| PbCl2 | 1,7∙10-5 |
| PbS (18 oC) | 1,1∙10-29 |
| PbSO4 | 1,8∙10-8 |
| SrCO3 | 9,42∙10-10 |
| SrSO4 | 2,8∙10-7 |
| ZnCO3 | 6∙10-11 |
| Zn(OH)2 (20oC) | 4∙10-16 |
Приложение 2
Стандартные, окислительно – восстановительные потенциалы (по отношению к потенциалу стандартного водородного электрода при t 25oC).
| Окисленная форма | Число получаемых электронов | Восстановленная форма | φ o, В |
| Li+ | Li | 3,045 | |
| Rb+ | Rb | -2,925 | |
| K+ | K | -2,925, | |
| Cs+ | Cs | -2,923 | |
| Ba2+ | Ba | -2,900 | |
| Sr2+ | Sr | -2,890 | |
| Ca2+ | Ca | -2,870 | |
| Na+ | Na | -2,714 | |
| La3+ | La | -2,522 | |
| Mg2+ | Mg | -2,370 | |
| AlO2- + 2H2O | Al + 4OH- | -2,350 | |
| Be2+ | Be | -1,847 | |
| Al3+ | Al | -1,662 | |
| ZnO22-+2H2O | Zn +4OH- | -1,216 | |
| Mn2+ | Mn | -1,180 | |
| SO42-+ H2O | SO32-+ 2OH- | -0,930 | |
| 2H2O | H2 + 2OH- | -0,828 | |
| Zn2+ | Zn | -0,763 | |
| Cr3+ | Cr | -0,744 | |
| Fe2+ | Fe | -0,440 | |
| Cd2+ | Cd | -0,403 | |
| Ti3+ | Ti2+ | -0,370 | |
| PbSO4 | Pb+(SO4)2- | -0,356 | |
| In3+ | In | -0,343 | |
| Ti+ | Ti | -0,336 | |
| CO2+ | Co | -0,277 | |
| Ni2+ | Ni | -0,250 | |
| Sn2+ | Sn | -0,136 | |
| (CrO4)2-+4H2O | Cr(OH)3+5OH- | -0,130 | |
| Pb2+ | Pb | -0,126 | |
| Fe3+ | Fe | -0,036 | |
| 2H+ | H2 | 0,000 | |
| (NO3)-+H2O | (NO2)-+2OH- | +0,010 | |
| S + 2H+ | H2S | +0,141 | |
| Sn4+ | Sn2+ | +0,150 | |
| Cu2+ | Cu+ | +0,153 | |
| (SO4)2-+ 4H+ | H2SO3+H2O | +0,170 | |
| AgCl | Ag+Cl- | +0,222 | |
| 2(SO4)2-+ 10H+ | (S2O3)2-+ 5H2O | +0,290 | |
| (ClO3)- + H2O | (ClO2)-+2OH- | +0,330 | |
| Cu2+ | Cu | +0,337 | |
| [Fe(CN)6]3- | [Fe(CN)6]4- | +0,360 | |
| (SO4)2- +8H+ | S+ 4H2O | +0,360 | |
| (ClO4)-+ H2O | (ClO3)-+ 2OH- | +0,360 | |
| O2 +2 H2O | 4OH- | +0,401 | |
| H2SO3 +4H+ | S+3H2O | +0,450 | |
| Cu+ | Cu | +0,521 | |
| I2 | 2I- | +0,536 | |
| H3AsO4 +2H+ | HAsO2+2H2O | +0,559 | |
| (MnO4)- | (MnO4)2- | +0,564 | |
| (MnO4)-+ 2H2O | MnO2+4OH- | +0,588 | |
| (MnO4)-+ 2H2O | MnO2+4OH- | +0,600 | |
| (ClO2)-+ H2O | (ClO)-+2OH- | +0,660 | |
| O2+2H+ | H2O2 | +0,682 | |
| (BrO)-+ H2O | Br -+2OH- | +0,760 | |
| Fe3+ | Fe2+ | +0,771 | |
| (NO3)-+2H+ | NO2+ H2O | +0,790 | |
| Hg22+ | 2Hg | +0,798 | |
| Ag+ | Ag | +0,799 | |
| O2+4H+(10-7м) | 2H2O | +0,815 | |
| Hg2+ | Hg | +0,854 | |
| (ClO)-+ H2O | Cl-+2OH- | +0,890 | |
| (NO3)- + 3H+ | HNO2+ H2O | +0,940 | |
| (NO3)- + 4H+ | NO+ 2H2O | +0,960 | |
| HNO2+H+ | NO+ H2O | +1,000 | |
| Br2 | 2Br – | +1,065 | |
| (IO3)-+6H+ | I -+3H2O | +1,090 | |
| 2(IO3)-+12H+ | I2 -+6H2O | +1,195 | |
| (ClO4)-+2H+ | (ClO3)-+ H2O | +1,190 | |
| O2+4H+ | 2H2O | +1,229 | |
| MnO2+4H+ | Mn2++2H2O | +1,230 | |
| Tl3+ | Tl | +1,125 | |
| HBrO+H+ | Br - + H2O | +1,330 | |
| (Cr2O7)2-+14H+ | 2Cr3++7 H2O | +1,330 | |
| Cl2 | 2Cl- | +1,359 | |
| (BrO3)-+6H+ | Br - + 3H2O | +1,440 | |
| (ClO3)-+6H+ | Cl-+3H2O | +1,450 | |
| PbO2+4H+ | Pb2++3H2O | +1,456 | |
| 2(ClO3)-+12H+ | Cl2 + 6H2O | +1,470 | |
| Au3+ | Au | +1,500 | |
| (MnO4)-+ 8H+ | Mn2+ + 4H2O | +1,510 | |
| 2(BrO3)-+ 12H+ | Br2 + 6H2O | +1,520 | |
| PbO2+4H++SO42- | PbSO4 + 2H2O | +1,685 | |
| (MnO4)-+ 4H+ | MnO2+2H2O | +1,695 | |
| H2O2+2H+ | 2H2O | +1,776 | |
| CO3+ | Co2- | +1,810 | |
| F2 | 2F- | +2,870 |
Приложение 3
 2015-01-13
2015-01-13 828
828








