Превращение атомов в положительно заряженные ионы определяется величиной энергии ионизации наружных электронов. Энергия ионизации электрона первого снаружи слоя является периодической функцией зарядов атомов ядер. Чем меньше энергия ионизации элемента, тем ярче выражены его восстановительные свойства. Это наблюдается у элементов, в атомах которых внешний энергетический уровень содержит только S электроны и одни p электроны. Например: K, Na, Mg, Ca.
По мере увеличения числа электронов в p – подуровне наружного энергетического уровня, энергия ионизации резко возрастает. Превращение атомов в отрицательно заряженные ионы определяется величиной сродства к электрону. Чем больше сродство, тем ярче выражены окислительные свойства элемента. Сродство к электрону является периодической функцией зарядов атомных ядер. У первых элементов каждого периода сродство к электрону очень мало. Значительной величины оно достигло у кислорода и элементов главной подгруппы VII группы, у них на p – подуровне содержится 4…5 электронов.
Поэтому в каждом периоде по мере повышения порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные свойства повышаются. В каждой главной подгруппе с повышением порядкового номера увеличиваются восстановительные свойства простых веществ и уменьшаются окислительные. Кислород “О” проявляется только окислительные свойства, фосфор – в основном, восстановительные. Элементы побочных подгрупп, атомы которых на внешнем энергетическом уровне содержат только S - электроны, проявляют только восстановительные свойства.
Вопрос32. Механизм возникновения электродного потенциала на границе металл -электролит. Влияние различных факторов на величину электродного потенциала. Уравнение Нернста. Измерение электродного потенциала. Ряд стандартных электродных потенциалов.
(При соприкосновении двух электропроводящих фаз — металла и электролита — между ними возникает разность потенциалов вследствие образования двойного электрического слоя как результата перехода заряженных частиц из одной фазы в другую.) Чаще всего металл контактирует с раствором электролита. Даже в атмосферных условиях в пленке влаги растворены различные газы: O2, H2S, SO2, CO2… Частный случай: контакт металла с раствором, содержащим его ионы (металл в растворе соли металла) Me|Me n+ Zn|ZnSO4 Zn|Zn 2+ Cu|Cu2+…
В этом случае все металлы можно разделить на две группы: одна группа – так называемые активные металлы, качественно ведут себя как в воде,Но возникает менее отрицательный электродный потенциал, т.к. ионы из раствора могут входить в кристаллическую решетку (Ni, Fe…). Пассивные металлы (Cu, Hg, Ag…) не переходят в ионное состояние при контакте с раствором их соли, а наоборот, ионы металла из раствора восстанавливаются на поверхность металла положительно. Возникает положительный электродный потенциал, а избыточные анионы соли создают отрицательный заряд у поверхности металла. Величина электродного потенциала зависит от трех энергетических факторов.
1) Энергия ионизации Eи (та энергия, которую надо затратить, чтобы оторвать электрон от нейтрального атома и превратить атом в положительно заряженный ион) Me – ē → Me+ – Eи
2) E кристаллической решетки. Eкр (это та энергия, которую затратить, чтобы разорвать химические связи в кристаллической решетке и удалить частицы друг от друга на бесконечно большое расстояние).
3) Е гидратации (активации) Eгидр (энергия, которая выделяется при взаимодействии положительно заряженных ионов с нейтральными молекулами воды) Me n+ + mH2O→[Me(H2O)m]n+ + Eгидр
Все эти энергии измеряются в кДж/моль 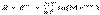 Величина электродного потенциала зависит от концентрации ионов металла в растворе его соли [Men+], их заряда (n) и температуры (Т), что выражается уравнением Нернста:
Величина электродного потенциала зависит от концентрации ионов металла в растворе его соли [Men+], их заряда (n) и температуры (Т), что выражается уравнением Нернста:
 здесь F – число Фарадея (F=96485 96500 Кл/моль).
здесь F – число Фарадея (F=96485 96500 Кл/моль).
При Т=298 К можно применять упрощенную форму уравнения Нернста:
Измерить абсолютное значение электродного потенциала практически невозможно, измеряют ЭДС гальванического элемента в котором один электрод исследуемый, а другой – электрод сравнения, чаще всего водородный электрод, потенциал которого условно принят за 0. И это ЭДС считается электродным потенциалом данного электрода (по водородной шкале) и называется стандартным (нормальным) электродным потенциалом. Этот ряд водорода называется ещё рядом напряжений или рядом активности металла.
Li|Li+
Rb|Rb+
K|K+
Cs|Cs+
Al|Al3+
Mg|Mg2+
Zn|Zn2+
Fe|Fe2+
Ni|Ni2+
Sn|Sn2+
Pt,H2|2H+
Cu|Cu2+
Ag|Ag+
Au|Au3+
-3.045
-2.925
-2.925
-2.923
-1.662
-1.18
-0.763
-0.44
-0.25
-0.126
+0.34
+0.8
+1.5
измеряется в Вольтах
Чем больше положительный электродный потенциал, тем устойчивее металл в контакте с другими металлами, следовательно, он труднее окисляется, а его положительные ионы легче восстанавливаются из растворов электролитов, следовательно, легче получить этот металл из вольтных растворов на катоде в случае электролиза.
Вопрос33. Химические источники электрической энергии. Гальванический элемент. Аккумулятор. Устройство и принцип работы гальванического элемента. Электрохимическая схема гальванического элемента. Э.Д.С. гальванического элемента. Химические и концентрационные гальванические элементы.
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергиюВиды ХИТ: аккумулятор, гальвонический элемент, топливный элемент. Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
 Гальвани́ческий элеме́нт — хим источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить. Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью. ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:U = Eэ – I(r1–r2) – ΔE, В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с ум-м концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах. Хим элементами наз такие элементы, у кот ЭДС возникает за счет хим реакции, протекающей в гальваническом элементе. Концентрационный элемент с переносом вещества получ в результате соприкосновения двух растворов одного и того же электролита с разными активностями(концентрациями),в кот помещены одинаковые электроды, обратимые по одному из ионов электролита.
Гальвани́ческий элеме́нт — хим источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить. Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью. ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:U = Eэ – I(r1–r2) – ΔE, В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с ум-м концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах. Хим элементами наз такие элементы, у кот ЭДС возникает за счет хим реакции, протекающей в гальваническом элементе. Концентрационный элемент с переносом вещества получ в результате соприкосновения двух растворов одного и того же электролита с разными активностями(концентрациями),в кот помещены одинаковые электроды, обратимые по одному из ионов электролита.
Вопрос34. Электролиз расплавов. Электролиз водных растворов электролитов с инертным и активным анодом.
Электролиз – окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе энергия электрического тока превращается в хим энергию, иначе говоря, осущ-ся процесс, обратный по характеру происходящему в гальваническом элементе.Э лектролиты – проводники второго рода. При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осущ-и за счет электрической энергии хим реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы наз процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия хим окислителей и восстановителей. Различают электролиз расплавов и растворов электролитов. Электролиз расплавов солей
1)Все катионы металлов восстанавливаются на катоде: К(-): Zn2+2e-→Zn0;Na+ + 1e- → Na0
2)Анионы бескислородных кислот окисляются на аноде: А(+): 2Cl¯ - 2e-→Cl2
3)Анионы кислородсодержащих кислот образуют соответствующий кислотный оксид и кислород: А(+): 2SO42ˉ - 4e- → 2SO3 + O2 Электролиз водных растворов электролитов На ход процесса электролиза и характер конечных продуктов большое влияние оказывают природа растворителя, материал электродов, плотность тока на них и другие факторы. В водных растворах электролитов, кроме гидратированных катионов и анионов, присутствуют молекулы воды, которые также могут подвергаться электрохимическому окислению и восстановлению. Какие именно электрохимические процессы будут протекать на электродах при электролизе, зависит от значения электродных потенциалов соответствующих электрохимических систем. Катодные процессы. При прочих равных условиях ионы металлов восстанавливаются на катоде тем легче, чем менее активен металл, чем дальше вправо он расположен в ряду напряжений
1) Катионы металлов, имеющие электродный потенциал более высокий, чем у ионов водорода Н+ (в ряду напряжений эти металлы стоят после Н2), при электролизе практически полностью восстанавливаются на катоде: Cu2+ + 2e- → Cu0
2) Катионы металлов, имеющие низкую величину электродного потенциала (от начала ряда напряжения по алюминий включительно), не восстанавливаются на катоде и остаются в растворе, на катоде идет процесс электрохимического восстановления водорода из молекул воды: 2H2O + 2e- → H2 + 2OH¯
3) Катионы металлов, имеющие электродный потенциал ниже, чем у ионов водорода (Н+), но выше, чем у ионов алюминия (Al3+), т.е стоящих между Zn2+→ Men+ ← H2, при электролизе восстанавливаются на катоде одновременно с водородом. Fe3+ + 3e- → Fe0 2H2O + 2e- → H2 + 2OH¯ Таким образом, характер катодного процесса при электролизе водных растворов электролитов определяется, прежде всего, положением соответствующего металла в ряду напряжения Анодные процессы.
При электролизе веществ используется инертные, не изменяющиеся в процессе электролиза аноды (графитовые, платиновые) и растворимые аноды, окисляющиеся в процессе электролиза легче, чем анионы (из цинка, никеля, серебра, меди и других металлов).
1) Анионы бескислородных кислот (S2ˉ, I¯, Br¯, Cl¯) при их достаточной концентрации легко окисляются до соотв простых веществ.
2) При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также плавиковой кислоты и фторидов происходит электрохимическое окисление воды с выделение кислорода: в щелочных растворах: 4OH¯ - 4e- → O2 + 2H2O в кислых и нейтральных растворах: 2H2O - 4e- → O2 + 4H+
 2015-01-13
2015-01-13 2265
2265
