Растворы – это однородные (гомогенные) системы, сост. из двух или более компонентов (составных частей), количества которых могут изменяться в широких пределах. Раствор сост из растворенного вещества и растворителя, т.е. среды, в кот растворенное вещ-о равномерно распределено в виде молекул или ионов. Различают газовые, жидкие и тв растворы. Наибольшее распространение имеют жидкие растворы. Растворы, в отличие от хим соединений, имеют не постоянный состав, поэтому необходимо учитывать его концентрацию.
Состав раствора может быть выражен разными способами:
моляльность – отношение кол-ва растворенного вещества в молях к массе растворителя:
Смоляльн=νраст вещества/mрастворителя;
объёмная доля (φ) – отношение объма раствор вещества к общему объёму системы:
φ=Vкомпонента/Vсистемы
мольная доля(χ) – отношение кол-ва вещества компонента к сумме количеств всех веществ в системе: χ=νкомпонента/∑νзаствора
массовая доля () - отношение массы растворенного вещества (г, кг) к массе всего раствора в процентах, т.е. показывает, сколько граммов растворенного вещества содержится в 100 г раствора:
mр-ра = Vр-ра р-ра; mр-ра = mв-ва + mрастворителя
= 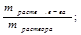
 % = 100 %;
% = 100 %;
массовая концентрация- отн-е массы компонента к объему системы: Смасс=mкомпонента/Vраствора;
молярная концентрация (молярность, СМ) показывает количество молей растворенного вещества, содержащихся в 1 л раствора
СM = 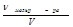 =
= 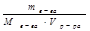 ;
;
нормальная концентрация (нормальность, СH) показывает количество моль-эквивалентов растворенного вещества (эквивалентов), содержащихся в 1 л раствора
СН = 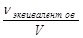 =
= 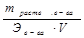 .
.
Эквивалентом вещества называется такое его количество, которое соединяется, вытесняет или замещает 1моль атомов водорода. Масса эквивалента, выраженная в граммах, называется эквивалентной массой.Для определения нормальности раствора необходимо уметь рассчитывать эквивалентную массу нерганических веществ.
22. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов. в растворы неэлектролитов (мол. растворах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. растворы неэлектролитов могут быть твердыми, жидкими и газообразными. Взаимная растворимость двух жидкостей при заданных температуре Т и давлении р м. б. полной (неограниченной) или ограниченной. В последнем случае растворы в некоторой области составов расслаиваются, т. е. разделяются на две жидкие фазы, отличающиеся по концентрации. В многокомпонентных расслаивающихся растворах число сосуществующих жидких фаз м. б. более двух. Если один (или более) из компонентов растворы неэлектролитов в чистом состоянии при заданных Т и р является газом или твердым телом. Давление пара растворителя над раствором. Закон Рауля. Между жидкостью и ее насыщенным паром существует динамическое равновесие жидкость↔ насыщенный пар, т.е. число молекул жидкости, испаряющихся с поверхности, равно числу конденсирующихся молекул. Этому равновесию соответствует давление насыщенного пара растворителя над чистым растворителем 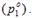 Нижний индекс (1) обозначает то, что свойство относится к растворителю; (2) – к растворенному веществу, а верхний индекс (о) указывает на то, что это свойство вещества в чистом состоянии; в данном случае это свойство чистого растворителя. Рауль сформулировал закон: давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя:
Нижний индекс (1) обозначает то, что свойство относится к растворителю; (2) – к растворенному веществу, а верхний индекс (о) указывает на то, что это свойство вещества в чистом состоянии; в данном случае это свойство чистого растворителя. Рауль сформулировал закон: давление насыщенного пара растворителя над раствором пропорционально молярной доле растворителя: 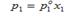
Выражение для молярной массы растворенного вещества
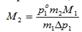 =>, измеряя экспериментально давление насыщ пара растворителя над раствором можно опр-ь молярную массу растворенного вещества.
=>, измеряя экспериментально давление насыщ пара растворителя над раствором можно опр-ь молярную массу растворенного вещества.
Температура замерзания и кипения растворов. Эбулиоскопия. Криоскопия. Понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
Согласно первому следствию из закона Рауля повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворенного вещества:
ΔТкип.=ЕСm(2) (7.6)
ΔТзам..=KСm(2) (7.7),
где Сm(2)Сm(2) – моляльная концентрация раствора; Е - эбулиоскопическая и К – криоскопическая постоянные, соответствующие повышению температуры кипения и понижению температуры замерзания раствора с Сm(2)=1 моль/1000 г растворителя. Значения Е и К зависят только от природы растворителя.
Согласно второму следствию из закона Рауля: эквимолекулрные количества различных неэлектролитов, растворенные в одинаковых количествах по массе одного и того же растворителя увеличивают температуру кипения или понижают температуру замерзания на одно и то же число градусов.
Осмос. Закон Вант-Гоффа. Процесс самопроизвольного перехода растворителя
(диффузия) через полупроницаемую мембрану, называемый осмосом.
Давление, которое необходимо приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением. Если давление, приложенное к более концентрированному раствору, больше осмотического, то растворитель будет переходить из раствора в растворитель. Процесс носит название обратный осмос и используется для очистки природных и сточных вод, в частности, может быть использован для водоподготовки в теплоэнергетике.Зависимость осмотического давления от температуры и концентрации описывается уравнением: π = с(В)RT, где π – осмотическое давление; с(В) – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная; T – температура, К.Закон Вант-Гоффа: осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор. Из закона Вант-Гоффа следует, что растворы различных неэлектролитов одинаковой концентрации, находящиеся при одинаковой температуре являются изотоническими, т.е. имеющими одинаковое осмотическое давление.
23. Растворы электролитов, содержат в заметных концентрациях ионы-катионы и анионы. образующиеся в результате электролитической диссоциации молекул растворенного вещества. Р-ритель (чистый или смешанный) обычно в сколько-нибудь значит. степени не диссоциирован. Р. э. обладают способностью проводить электрич. ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных растворы электролитов (т. е. свойства, зависящие только от концентрации растворенного вещества, но не от его природы) существенно отличаются от тех же свойств растворов неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления в сравнении со значением, предсказываемым законом Вант-Гоффа (см. Осмос), понижение давления пара растворителя над раствором в сравнении с предсказываемым Рауля законом и др.
вопрос о механизме электролитической диссоциации.
Легче всего диссоциируют вещ с ионной связью.эти вещества состоят из ионов.При их растворении диполиводы ориентируются вокруг положительного и отрицательного ионов.Между ионами и диполями воды возникают силы взаимного притяжения.В результате связь между ионами ослабевает,происходит переход ионов из кристалла в раствор. При этом образуютсягидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Аналогично диссоциируют и электролиты,молекулы которых образованы по типу полярной ковалентной связи(полярные молекулы).Вокруг каждой полярной молекулы вещества также ориентируютсядиполи воды,которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы,а положительными полюсами-к отрицательному полюсу.В результате этого взаимодействия связующее электронное облако (электронная пара)полностью смещается к атому с большей электроотрицательностью,полярная молекула превращается в ионную и затем легко образуются гидратированные ионы 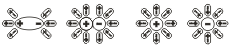 . Диссоциация полярных молекул может быть полной или частичной.
. Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью - соли, кислоты и основания. И диссоциировать на ионы они могут в полярных растворителях.
Основными причинами электролитической диссоциации являются, с одной стороны, взаимодействие растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны - значительное ослабление электростатических взаимодействий между сольватированными ионами в среде, обусловленное ее электростатическим полем (диэлектрической проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллической решетки), обеспечивается за счет энергии сольватации.
24. Количественная характеристика диссоциации электролитов называется степенью диссоциации (обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества вионыполная.Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):α = cд / cB
всегда меньше единицы, но больше нуля (0 < α < 1).
В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4 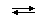 H+ + H2PO4− (α = 23,5%)
H+ + H2PO4− (α = 23,5%)
H2PO4− 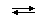 H+ + HPO42− (α = 3 · 10−4%)
H+ + HPO42− (α = 3 · 10−4%)
HPO42− 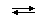 H+ + PO43− (α = 2 · 10−9%)
H+ + PO43− (α = 2 · 10−9%)
Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.
Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается. Количественная характеристика диссоциации электролитов называется степенью диссоциации (обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная.
Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):
α = cд / cB
всегда меньше единицы, но больше нуля (0 < α < 1).
В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4 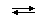 H+ + H2PO4− (α = 23,5%)
H+ + H2PO4− (α = 23,5%)
H2PO4− 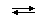 H+ + HPO42− (α = 3 · 10−4%)
H+ + HPO42− (α = 3 · 10−4%)
HPO42− 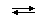 H+ + PO43− (α = 2 · 10−9%)
H+ + PO43− (α = 2 · 10−9%)
Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.
Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
25. реакции среды.
Вода достаточно плохо диссоциирует. Но всё же обладает измеримой проводимостью. Вода диссоциирует на катионы водорода и анионы гидроксила. Так как степень диссоциации воды крайне мала то концентрация недиссоциированных молекул H2O в воде практически равна общей концентрации воды. Для воды и разбавленных водных растворов при неизменной температуре произведение ионов водорода и гидроксил -ионов есть величина постоянная = ионное произведение воды.=10-14. Растворы в которых концентрации ионов водорода = концентрации ионов гидроксила называются нейтральными([H+]=10-7). Если водорода больше([H+]>10-7) то кислый, если гидроксила([H+]<10-7), то основной, но произведение ВСЕГДА остаётся постоянным. Кислотность или щелочность среды выражается водородным показателем pH=-lg[H+] Методы измерения: колориметрический и потенциометрический. Колориметрический метод основан на свойстве кислотно – основных индикаторов изменять свою окраску в зависимости от активности ионов водорода в растворе (в общем по цвету индикатора). Потенциометрический метод – электрохимический метод анализа, основанный на зависимости величины электродного потенциала, а, следовательно, и ЭДС, составленного из соответствующих электродов гальванического элемента, от состава раствора (Короче проводимость воды)
26. Условия практической необратимости реакций ионного обмена: образование осадка, выделение газа, образование воды или другого слабого электролита. Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа или осадка
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
27. Гидролиз солей – процесс взаимодействия в-ва с водой, при котором составные части в-ва взаимодействуют с составными частями воды, образуя слабодиссоциирующие ионы или молекулы. При гидролизе происходит изменение реакции среды. Гидролизу подвергаются соединения различных классов. Гидролизу будут подвергаться соли, образованные: а)сл.основание и сильн.кислотой. б)сл.кислотой и силь.основание в)сл.кислотой и сл. основанием.; Соли образованные силь.основ и силь.кисл (NaCl,NaNO3) гидролиз является процессом обратимым: чем слабее электролит, образующий соль, тем глубже протекает процесс гидролиза. Гидролиз протекает тем полнее, чем слабее электролит, образовавший соль, чем выше температура и чем больше разбавление раствора.
Степень гидролиза – доля в-ва подвергшееся гидролизу. Зависит: от константы равновесия, от температуры, от концентрации соли. Константа гидролиза – это отношение произведения концентраций кислоты и основания к концентрации образовавшейся соли.Kгидр=Кв /Кд.сл.электр.
1) Al2 (SO4)3+H2O=2AlOHSO4+H2SO4 (сл. + сильн.)
2) Na2CO3+H2O=NaHCO3+NaOH (сильн. + сл.)
3) Cr2 (CO3)3+H2O=Cr(OH)3|-+H2CO3(сл. +сл.)
4)KNO3 гидролизу не подвергается (сильн. + сильн.)
28. Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
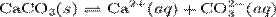
Константа этого равновесия рассчитывается по уравнению:
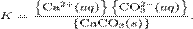
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
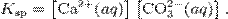
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
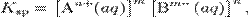
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
при увеличении конц-и одного из ионов электролита в его насыщ растворе произведение концентраций ионов электролита становится больше ПР.При этом равновесие между ТВ фазой и раствором смещается в сторону образования осадка.Условием обр-я осадка явл превышение произведения концентраций ионов малорастворимого электролита над его ПР.РАСТВОРЕНИЕ осадка малораст электролита происходит при условии, что произведение конц-й его ионов <значения ПР.
29. ОВР – такие реакции, в результате которых изменяется степень окисления одного из реагирующих веществ. Степень окисления – условный заряд атома в молекуле, возникающий, исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательному. Процесс окисления – процесс отдачи электронов атомами, молекулами или ионами, при этом степень окисления повышается, а вещество является восстановителем. Процесс восстановления – процесс присоединения электронов атомами, молекулами или ионами, при этом степень окисления понижается, а вещество является окислителем. Окислитель – вещество, которое принимает электроны, при этом оно восстанавливается. Восстановитель – вещество, которое отдает электроны, при этом оно окисляется. Типичные восстановители: активные металлы (щелочные и щелочноземельные, Zn, Al, Fe, и др. Me0 –ne à Me +n), а также некоторые неметаллы, H2 и C (в виде угля или кокса),S. Типичные окислители - неметаллы (F2,Cl2,Br2,I2, O2), галогены, выступая в кач. окислителей, приобретают степень окисленности -1 (от F к I окислительные св-ва ослабевают).
30.метод электронно-ионного баланс а. В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция. При составлении уравнений процессов окисления и восстановления для уравнивания числа атомов водорода и кислорода вводят (в зависимости от среды) или молекулы воды и ионы водорода (если среда кислая), или молекулы воды и гидроксид-ионы (если среда щелочная). Соответственно и в получаемых продуктах в правой части электронно-ионного уравнения будут находиться ионы водорода и молекулы воды (кислая среда) или гидроксид-ионы и молекулы воды (щелочная среда).Т. е. при написании электронно-ионных уравнений нужно исходить из состава ионов, действительно имеющихся в растворе. Кроме того, как и при составлении сокращенных ионных уравнений, вещества малодиссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.Рассмотрим для нашего случая полуреакцию окисления. Молекула FeS2 превращается в ион Fe3+ (Fе(NО3)3 полностью диссоциирует на ионы, гидролизом пренебрегаем) и два иона SO42- (диссоциация H2SO4): 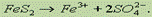 Для того чтобы уравнять кислород, в левую часть добавим 8 молекул Н2О, а в правую — 16 ионов Н+ (среда кислая):
Для того чтобы уравнять кислород, в левую часть добавим 8 молекул Н2О, а в правую — 16 ионов Н+ (среда кислая): 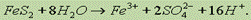 Заряд левой части равен 0, заряд правой +15, поэтому FeS2 должен отдать 15 электронов:
Заряд левой части равен 0, заряд правой +15, поэтому FeS2 должен отдать 15 электронов:
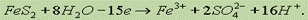 Рассмотрим теперь полуреакцию восстановления нитрат-иона:
Рассмотрим теперь полуреакцию восстановления нитрат-иона:  Необходимо отнять у NО3 2 атома О. Для этого к левой части добавим 4 иона Н1+ (кислая среда), а к правой — 2 молекулы Н2О:
Необходимо отнять у NО3 2 атома О. Для этого к левой части добавим 4 иона Н1+ (кислая среда), а к правой — 2 молекулы Н2О:  Для уравнивания заряда к левой части (заряд +3) добавим 3 электрона:
Для уравнивания заряда к левой части (заряд +3) добавим 3 электрона: 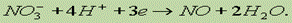
Окончательно имеем:
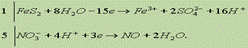
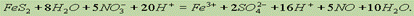
Сократив обе части на 16Н+ и 8Н2О, получим сокращенное ионное уравнение окислительно-восстановительной реакции:
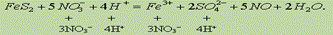
Добавив в обе части уравнения соответствующее количество ионов NO3- и Н+ находим молекулярное уравнение реакции: 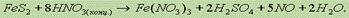
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например: 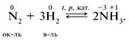
Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например: 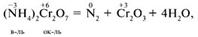
или один химический элемент в разных степенях окисления, например:
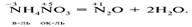
Диспропорционирование (самоокисление-самовосстановление) - окислителем и восстановителем явл один и тот же элемент, находящийся в промежуточной степени окисления, например: 
 2015-01-13
2015-01-13 4015
4015
