Влияние температуры и природы растворителя на растворимость осадка
Процесс растворения большинства малорастворимых соединений эндотермичен, поэтому с повышением температуры растворимость, как правило, увеличивается.
Повышение растворимости осадка при нагревании используют в гравиметрическом анализе для получения крупнокристаллических осадков.
Уменьшение растворимости с ростом температуры встречается редко и связано обычно с изменением структуры кристаллической решётки. Например, при to= 20 - 60оС сульфат кальция существует в виде дигидрата (CaSO4∙2H2O). При увеличении температуры до 60оС его растворимость возрастает. После 60оС он переходит в форму CaSO4∙1/2H2O и растворимость его при дальнейшем увеличении температуры уменьшается.
Природа растворителя оказывает существенное влияние на растворимость осадка. Растворимость большинства соединений катионов с анионами неорганических кислот уменьшается при введении органических растворителей. Добавление к воде органических растворителей часто используют в практике для изменения растворимости веществ. Например, для увеличения полноты осаждения сульфата кальция из водных растворов к ним добавляют этиловый спирт.
Осадки, содержащие анионы органических кислот (оксихиналинаты, диэтилдитиокарбаминаты, ацетилацетонаты металлов), напротив, более растворимы в органическом растворителе. Справедлив тезис: «Подобное растворяется в подобном.»
В заключение следует напомнить соотношение между термодинамическим, концентрационными (реальным и условным) произведениями растворимости [ термодинамической, концентрационными (реальной и условной) константами растворимости ]
и расчетными формулами растворимости:
для идеальной системы:
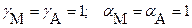
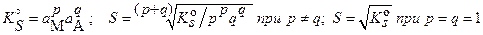
для реальных систем:
а) в присутствии посторонних электролитов: 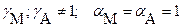
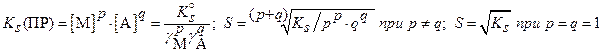
б) при наличии конкурирующих равновесий протонирования и комплексообразования и в отсутствии посторонних электролитов: 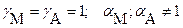
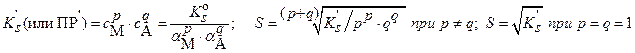 в) ) при наличии конкурирующих равновесий протонирования и комплексообразования и в присутствии посторонних электролитов:
в) ) при наличии конкурирующих равновесий протонирования и комплексообразования и в присутствии посторонних электролитов: 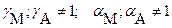
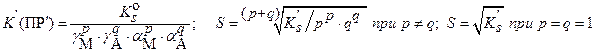
 2014-02-09
2014-02-09 6634
6634