Глава 8 Молекулярно-кинетическая теория идеальных газов
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
Опытным путем, еще до появления молекулярно-кинетической теории, был установлен целый ряд законов, описывающих поведение идеальных газов, которые мы и рассмотрим.
Закон Бойля — Мариотта (Р. Бойль (1627—1691) — английский ученый; Э. Мариотт (1620—1684) — французский физик): для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
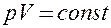 (41.1)
(41.1)
при Т = const, m = const.
Кривая, изображающая зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис.60).
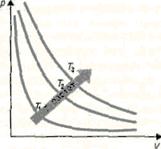
Рис. 60
Закон Гей-Люссака (Ж. Гей-Люссак (1778—1850) — французский ученый):
1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
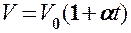 (41.2)
(41.2)
при p = const, m = const;
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:
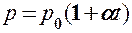 (41.3)
(41.3)
при V = const, m = const.
В этих уравнениях t — температура по шкале Цельсия, ро и V0 — давление и объем при 0 °С, коэффициент 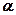 = 1/273,15 К-1.
= 1/273,15 К-1.
Рис. 61 Рис. 62
Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис.61) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах р, t (рис. 62) он изображается прямой, называемой изохорой.
Из (41.2) и (41.3) следует, что изобары и изохоры пересекают ось температур в точке t = -1/ 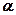 = -273,15°С, определяемой из условия 1 +
= -273,15°С, определяемой из условия 1 + 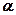 = 0. Если сместить начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 62), откуда
= 0. Если сместить начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 62), откуда
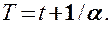
Вводя в формулы (41.2) и (41.3) термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:

или
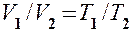 (41.4)
(41.4)
при р = const, m = const,
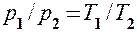 (41.5)
(41.5)
при V = const, m = const,
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон Авогадро (А. Авогадро (1776—1856) — итальянский физик и химик): моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41×10-3 м3 /моль.
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
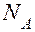 = 6,022×1023 моль-1.
= 6,022×1023 моль-1.
Закон Дальтона (Дж. Дальтон (1766—1844) — английский химик и физик): давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т. е.
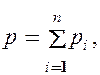
где р i — парциальные давления — давления, которые оказывали бы газы смеси, если бы они одни занимали объем, равный объему смеси при той же температуре.
 2015-01-21
2015-01-21 2409
2409







