Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы и сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно повысить за счет сообщения ему некоторого количества теплоты — энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами). Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U 2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии 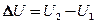 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой A, совершенной системой против внешних сил:
будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой A, совершенной системой против внешних сил:
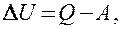
или
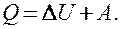 (51.1)
(51.1)
Уравнение (51.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Выражение (51.1) в дифференциальной форме будет иметь вид dQ=dU+dA, или в более корректной форме
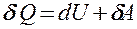 (51.2)
(51.2)
где dU — бесконечно малое изменение внутренней энергии системы,  — элементарная работа,
— элементарная работа, 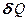 — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а
— бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а  и
и 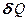 таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (51.2).
таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (51.2).
Из формулы (51.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии 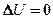 . Тогда, согласно первому началу термодинамики
. Тогда, согласно первому началу термодинамики
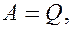
т.е. вечный двигатель первого рода— периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия,— невозможен (одна из формулировок первого начала термодинамики).
 2015-01-21
2015-01-21 763
763








