Открытия в области физики молекул и газов позволили ученым убедиться экспериментально в том, что все вещест- ва, в том числе и живые организмы, состоят из мелких и не- делимых частиц – атомов. Человек осознал и научился ис- пользовать такие понятия как масса, объем, давление и тем- пература. Были созданы устройства, позволяющие их изме- рять. Между ними были установлены закономерные связи, открыты законы газов. Исследования в области физики мо- лекул позволили сделать важный шаг к развитию химии и биохимии, статистической физики.
Описание состояния различных веществ, например газа, можно осуществлять с помощью различных теоретических подходов.
Микроскопическое описание рассматривает детали дви- жения и взаимодействия молекул в рамках кинетической теории и статистической механики7. Пример микроскопиче- ского описания – это использование законов механики для описания движения и столкновения между собой молекул
или атомов. Составленные, таким образом системы уравне- ний позволяют объяснить, например, возникновение давле- ния газа на стенки сосуда или получить уравнение газового состояния с точки зрения микроскопического описания.
Макроскопическое описание оперирует с измеряемыми физическими величинами: массой, объемом, давлением, тем- пературой. Например, состояние газа в сосуде описывается тремя переменными: V (объем), P (давление), T (температу- ра). В квартире воздух, заполняющий ее, также характеризу-

7 Статистическая механика – это раздел физики, рассматриваю- щий закономерности движения большого числа частиц.
ется объемом, температурой и давлением. Такие величины называют параметрами состояния. Изучением процессов с помощью макроскопических величин занимается термоди- намика.
Кинетической называют теорию, согласно которой веще- ство состоит из атомов, совершающих непрерывное хаотиче- ское движение.
Строение вещества. Идея о существовании мельчайших неделимых частиц принадлежит древнегреческому филосо- фу Демокриту8. Эти частицы он назвал атомами (от древне- греческого слова атомос – «неделимый»).
Экспериментальные подтверждения справедливости ато- мной теории были получены лишь в XVIII в. Вполне естест- венно объяснение таких характеристик веществ как прони- цаемость, сжимаемость, растворимость тем, что вещество не является сплошным, но состоит из отдельных частиц, между которыми есть промежутки. Притяжение молекул и атомов является причиной существования твердых и жидких тел. Однако при приближении атомов друг к другу между ними возникают силы отталкивания. Таким образом, средние рас- стояния между атомами остаются примерно одинаковыми. Видно, что сжать воду или какое-либо твердое тело практи- чески невозможно.
Явление диффузии – явление самопроизвольного взаим- ного проникновения веществ (рис. 2.1) – является подтвер- ждением того, что атомы и молекулы вещества находятся в постоянном и беспорядочном движении. Диффузия имеет место в газах, жидкостях и твердых телах. Это, например, запахи при диффузии в газах, самопроизвольное смешивание различных слоев жидкостей.
Ярким экспериментальным доказательством атомного строения вещества явились опыты английского ботаника Броуна в 1827 г. (рис. 2.2).

8 Греческий философ Демокрит жил ок. 460–370 гг. до н.э. Он был учеником и последователем греческих философов Анаксагора (500–428 гг. до н.э.), высказавшем мысль о существовании «нераз- рушимых элементов» и Левкиппа (V в. до н.э.), подхватившим идеи атомистики.
Он обнаружил в пыльцы непрерывно
микроскоп, что крупинки цветочной хаотически движутся. Их беспорядоч-
ное движение объяснялось столкновениями с молекулами воды. Интенсивность такого движения обусловлена соотно- шением массы частиц и молекул воды. Массивные частицы не испытывали хаотического движения. Мелкие – при столк- новениях с молекулами воды сильно изменяют направление своего движения. Количественная теория броуновского дви- жения была разработана Эйнштейном в 1905 г. Он оценил на основе экспериментальных данных размер и массу атомов и
молекул, которые составили около 10–10 м
и 10–27 кг.

Рис 2.1. Диффузия капли чернил
в воде
Рис. 2.2. Движение броуновской частицы
Температура. Представление о горячем и холодном мы связываем с понятием температуры. Температура влияет на многие свойства веществ: плотность, объем, давление, элек- трическое сопротивление, вязкость, цвет и т.д. Уже в древние времена ученые пытались и не безуспешно теплом лечить различные недуги.
С точки зрения микроскопической теории с ростом тем-
пературы
атомы вещества колеблются вокруг своего поло-
жения равновесия с большей амплитудой
(пропорционально
ее квадрату). С понижением температуры молекулы двига- ются с меньшей средней скоростью. Поэтому мы ощущаем холод.
Измерение температуры осуществляется термометром. Первый такой прибор был изобретен в XVII в. Галилеем, в нем ученый использовал расширение газа. Газовый термо- метр показан на рис. 2.3. Термометр работает при постоян- ном объеме для разных типов газов.
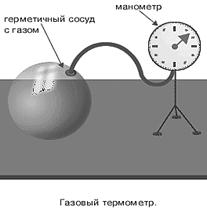
Рис. 2.3. Газовый термометр
Тепловое расширение. Изменение температуры тела приводит к линейному и объемному расширению тел. Нагре- ваясь, тела увеличивают свои линейные размеры и объем, а охлаждаясь, – уменьшают. Эта зависимость в широком ин- тервале температур носит линейный характер. Линейное раc- ширение тел определяется соотношением
l = l 0(1 + αt), (2.1.1)
где α – коэффициент линейного расширения вещества, l 0 –
длина при температуре 0ºС.
Физическая причина возникновения линейного и объем- ного расширения тел заключается в том, что с ростом темпе- ратуры увеличивается амплитуда колебаний атомов в веще- стве друг относительно друга. Поэтому среднее расстояние между ними возрастает. Линейное и объемное расширение тел – по смыслу это один и тот же эффект, поскольку рас- стояние между атомами увеличивается по трем координатам. В случае, когда поперечные размеры тела малы, то учитыва- ется их линейное расширение, а расширением тел в попереч-
ном направлении можно пренебречь. В случае, когда разме- ры тела в трех измерениях сравнимы по величине, рассмат- ривают объемное расширение.
При строительстве железных дорог необходимо учиты- вать только линейное расширение рельсов, поскольку их ли- нейные размеры много больше поперечных. Между рельсами предусматривается зазор 1–2 см. Летом рельсы могут разо- греваться до температуры 50ºС, а зимой их температура мо- жет достигать –50ºС. Коэффициент линейного расширения
стали ~10–5, что при длине рельса 20 м составит увеличение
длины на
~2 см. При отсутствии зазора
рельсы могут под-
няться, что приведет к аварии на железной дороге.
Объемное расширение тел определяется соотношением
V = V 0(1 + βt),
(2.1.2)
где β – коэффициент объемного расширения вещества, V 0–
объем системы при температуре 0ºС.
Коэффициенты α и β связаны соотношением
β ≈ 3 α.
(2.1.3)
Коэффициенты линейного и объемного расширения измеря- ются в обратных градусах Цельсия град–1. Их величины для
жидкостей
составляют 10–3–10–4 град–1,
а для твердых ве-
ществ 10–5–10–6 град–1. Явление теплового расширения тел положено в основу работы различных термометров, где в ка- честве термометрической величины выступает высота стол- бика из жидкости, газа или твердого тела (рис. 2.4).
. 
Рис. 2.4. Ртутный термометр (а); биметаллический термометр (б)
Законы идеального газа. Идеальным называют газ, мо- лекулы которого представляют собой материальные точки, все столкновения которых являются абсолютно упругими, и потенциальной энергии взаимодействия между ними нет. Поэтому в модели идеального газа происходит хаотическое движение материальных точек, которые взаимодействуют между собой только в результате упругого столкновения.
Описание состояния системы заключается в установле- нии связи между макроскопическими параметрами (V, P, Т, m). Когда один или два макропараметра системы постоянны, за- висимости носят название изопроцессов.
Процесс, при котором давление и объем газа меняются,
m = const, T = const, называется изотермическим:
PV = const, m = const, T = const. (2.1.4)
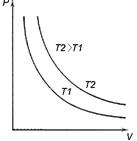
Этот закон был открыт Бойлем и Мариоттом (рис. 2.5, а) од- новременно и получил название закона Бойля–Мариотта 9.
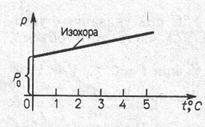
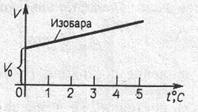
Экспериментально были установлены линейные зависи- мости объема и давления идеального газа от температуры V
= V (T) и P = P (Т), которые получили название законов соот- ветственно Шарля (рис. 2.5, б) и Гей-Люсcака (рис. 2.5, в):
P = P 0(1 + αt),
или
Р 1= Т 1, m = const, V = const (2.1.5)

 Р 2 Т 2
Р 2 Т 2
– закон Гей-Люссака10

9 Впервые мысль о постоянстве произведения давления на объем была высказана английским физиком Р. Тоунли. Такие же иссле- дования проводил врач Г.Пауэр. Английский физик Роберт Бойль провел исследования в широких пределах и опубликовал результа- ты в 1662 г., а независимо от него французский физик Э. Мариотт опубликовал свои исследования в 1676 г.
10 Гипотеза о пропорциональности давления температуре была высказана французским физиком Г.Амонтоном в 1702 г., а 100 лет
спустя французский физик Ж.Л. Гей-Люссак получил математиче- ское выражение этого закона. Им же был открыт в 1802 г. и закон пропорциональности объема газа температуре. Однако первым его 45
или
V = V 0(1 + αt),

 V 1 = T 1, m = const, P = const (2.1.6)
V 1 = T 1, m = const, P = const (2.1.6)
V 2 T 2
 – закон Шарля, где α – коэффициент объемного расширения или увеличения давления α = 1/273 град–1.
– закон Шарля, где α – коэффициент объемного расширения или увеличения давления α = 1/273 град–1.
а б
в
Рис. 2.5. Законы идеального газа: а) закон Бойля–Мариотта
(изотермы для T 2 > T 1); б) закон Шарля; в) закон Гей-Люсака
Уравнение состояния идеального газа. Из установлен- ных экспериментально законов изменения состояния идеаль- ного газа (2.1.4)–(2.1.6) следует

 PV = Р 0 V 0 = R = const, (2.1.7)
PV = Р 0 V 0 = R = const, (2.1.7)
T T 0
где R = 8.31 Дж/моль × К называют универсальной газовой по- стоянной.

открыл другой французский физик – Ж. Шарль, не опубликовав- ший результаты своих экспериментов.
Упомянутые законы являются частными случаями более общего уравнения газового состояния, которое называют уравнением Клапейрона.
Уравнение Клапейрона–Менделеева11для произвольной
массы идеального газа учитывает также и количество молей газа:
 PV = mRT = NkT, (2.1.8)
PV = mRT = NkT, (2.1.8)
m
где m / μ = N / N A= ν – число молей газа, k = R / N A=1.38·10–23
Дж/К – постоянная Больцмана.
Законы Бойля–Мориотта, Гей-Люсакка, Шарля и уравне- ние газового состояния являются частными случаями урав- нения Клапейрона–Менделеева.
Постоянство величины R для разных газов представляет гениальное отражение простоты природы. Итальянский уче- ный Амедео Авогадро12(1776–1856) установил, что равные объемы газов при равных давлениях и температурах имеют одинаковое число молекул N. Это видно из уравнения газо-
вого состояния, переписанного в виде
 N = PV, (2.1.9)
N = PV, (2.1.9)
kT
где k – постоянная Больцмана. При нормальных условиях газа, когда Т 0= 0ºС, Р 0= 1 атм, V 0= 22.4 м3 для любого вида газа количество молекул, называемое числом Авогадро, со- ставляет
N A= 6.02 · 1023моль–1. (2.1.10)
Закон Дальтона. Если в пустой объем впустить какой- либо газ, то он займет весь объем. Если объем заполнить воздухом, то давление будет равно давлению трех состав-

11Это уравнение впервые было получено в 1874 г. русским уче- ным Д.И. Менделеевым на основе обобщения результатов иссле- дований французского физика Б.П. Клайперона и записано в такой форме.
12 Гипотеза впервые была им сформулирована в 1811 г. В закон она превратилась в 1863 г. после того, как была доказана Клау- зиусом.
ляющих его газов (кислорода, азота и углекислого газа), т.е. давление смеси химически не взаимодействующих идеаль- ных газов равно сумме парциальных давлений этих газов (закон Дальтона):
Р = Р 1 + Р 2 + Р 3 + … + Рn, (2.1.11)
причем каждый газ в смеси создает парциальное давление, пропорциональное его молекулярной концентрации:

|
miV
где mi и μi – масса и молярная масса i -го компонента газовой смеси.
При нормальных условиях, т.е. при температуре 0ª (273 К) и давлении 101.3 кПа, объем Vµ (молярный объем) равен 0.022414 м3/ моль.
Основное уравнение молекулярно-кинетической тео- рии идеального газа устанавливает связь между микроско- пическим и макроскопическим подходами при описании со- стояния газа. Фактически оно устанавливает те же законо- мерности, что уравнения газового состояния и уравнение Клапейрона–Менделеева.
Уравнение молекулярно-кинетической теории имеет вид

 P = 1 nmv 2, (2.1.13)
P = 1 nmv 2, (2.1.13)
или
 mv 2
mv 2
P = 2 nW
 3 к
3 к
,(2.1.14)
 где Wк =
где Wк =
– кинетическая энергия молекул идеального
газа,
n = N
 V
V
– число молекул в единице объема. Это уравне-
ние связывает между собой макроскопический параметр дав- ление P с массой молекул и их среднеквадратичной скоро- стью v 2.
Сравнивая (2.1.9) и (2.1.14), видим, что средняя кинети- ческая энергия молекулы и температура связаны соотноше- нием
W = 1 m v 2
к 2
= 3 kT. (2.1.15)
Вдоль каждой из пространственных осей молекулы имеют одинаковую среднюю кинетическую энергию:
1 2 1
Wi = m v i
= kT. (2.1.16) 2
Таким образом, основное уравнение молекулярно-кине- тической теории устанавливает связь между средней кинети- ческой энергией молекул (микропараметр) и температурой газа (макропараметр).
Распределение Максвелла молекул по скоростям. В экспериментах по проверке молекулярно-кинетической теории, проведенных Штерном в 1920 г., была получена средняя скорость молекул, которая составила 650 м/c.
Однако при этом было замечено, что плотность распре- деления молекул по скоростям оказывалась неравномерной, что можно было объяснить различным количеством молекул, имеющих разные скорости. В последующих экспериментах была получена зависимость числа молекул от их скорости.
В газе, находящемся в состоянии равновесия, при данной температуре устанавливается некоторое стационарное со- стояние, не меняющееся со временем распределение молекул по скоростям. Это распределение описывается функцией f(r) – функцией распределения молекул по скоростям, кото- рая определяет относительное число молекул, скорости ко- торых лежат в интервале от r до r + dr, т.е.
 dN(r)= f(r)dr. (2.1.17)
dN(r)= f(r)dr. (2.1.17)
N
Аналитическое выражение, описывающее распределение мо- лекул по скоростям было получено выдающимся английским физиком Джеймсом Максвеллом:
3 mv 2

 f (V) = 4 p v 2 N (
f (V) = 4 p v 2 N (
m
 2 p kT
2 p kT
)2 e -2 kT. (2.1.18)
Кривые распределения молекул по скоростям начинают- ся в начале координат, асимптотически приближаются к оси абсцисс при бесконечно больших скоростях (рис. 2.6). Слева от максимума кривые идут круче, чем справа. То что кривая
распределения начинается в начале координат, означает, что неподвижных молекул в газе нет. Из того, что кривая асим-
птотически
приближается к оси абсцисс при бесконечно
больших скоростях, следует, что молекул с очень большими скоростями мало. Для того чтобы молекула могла приобре- сти при столкновениях очень большую скорость, ей необхо- димо получить подряд много таких столкновений, при кото-
рых она получает энергию, и
ни одного
столкновения, при
котором она ее теряет. А такая ситуация маловероятна.
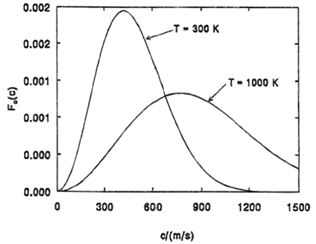
Рис. 2.6. Распределения Максвелла молекул газа по скоростям для различных температур
Уравнение Ван-дер-Ваальса. Экспериментальные ис-
следования
показали, что уравнение Бойля–Мариотта для
реальных газов выполняется не совсем точно. Причиной это- го является действие между молекулами сил как притяжения, так и отталкивания. Кроме того, молекулы лишь в идеальном приближении можно считать упругими и имеющими пренеб-
режимо малые размеры. Силы
межмолекулярного
взаимо-
действия очень сильно зависят от расстояния между молеку- лами. С ростом этого расстояния силы отталкивания убыва- ют быстрее, чем силы притяжения, а при уменьшении этого расстояния возрастают быстрее сил притяжения.
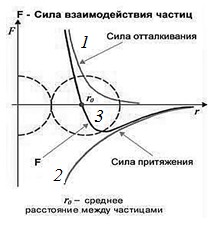
Рис. 2.7. Сила взаимодействия между молекулами; линия 3 – суммарное действие сил притяжения и отталкивания
Силы межмолекулярного взаимодействия – короткодей- ствующие – они проявляются на расстояниях менее 10–9м. Силы отталкивания и притяжения хорошо описываются фун-
кцией f ~ 1: сила отталкивания f
~ 1 (рис. 2.7, верхняя
 rn от
rn от

r12
 кривая), сила притяжения – fприт ~ r7 (рис. 2.7, нижняя кри- вая). Разная степень зависимости этих сил от расстояния ме- жду молекулами приводит к появлению положения устойчи- вого равновесия (рис. 2.7, красная линия) и минимальной по- тенциальной энергии взаимодействия молекул. Положение устойчивого равновесия определяется равенством сил при- тяжения и отталкивания. Колебания молекул происходят во- круг положения устойчивого равновесия. Минимальная энергия взаимодействия двух молекул соответствует ее зна- чению в положении равновесия, вокруг которого происходят их колебания (рис. 2.7).
кривая), сила притяжения – fприт ~ r7 (рис. 2.7, нижняя кри- вая). Разная степень зависимости этих сил от расстояния ме- жду молекулами приводит к появлению положения устойчи- вого равновесия (рис. 2.7, красная линия) и минимальной по- тенциальной энергии взаимодействия молекул. Положение устойчивого равновесия определяется равенством сил при- тяжения и отталкивания. Колебания молекул происходят во- круг положения устойчивого равновесия. Минимальная энергия взаимодействия двух молекул соответствует ее зна- чению в положении равновесия, вокруг которого происходят их колебания (рис. 2.7).
В реальном газе уравнение Менделеева–Клапейрона имеет несколько другой вид. Это обусловлено тем, что дав- ление реального газа на стенку оказывается ниже. Также меньше будет и объем пространства, в котором двигаются молекулы, поскольку они имеют реальный размер.
Физические причины уменьшения давления в реальных газах заключаются в следующем. На молекулу, находящуюся в поверхностном слое газа, как и при поверхностном натяже- нии жидкости, действует сила, направленная вовнутрь. Мо- лекулы, двигающиеся к стенке сосуда, замедляются под дей-
ствием этой силы. Уравнение
Клайперона–Менделеева ре-
ального газа было скорректировано Ван-дер-Ваальсом:
(P +
a

|
моля
|
- b) = RT.
(2.1.19)
Изотермы реальных газов представлены на рис. 2.7. При вы-
соких температурах
изотерма реального газа мало от-
личается от изотермы идеального газа (верхняя линия на рис. 2.7, а). При некоторой температуре – критической темпе- ратуре – на изотерме появляется точка перегиба K – крити-
ческая точка. Соответствующие этой точке объем
и давле-
ние называются критическими. Изотерма при называет- ся критической изотермой. При критической температуре теряется различие между жидкой и газообразной фазой ве- щества.
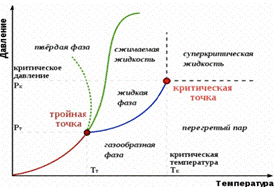
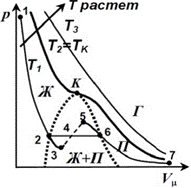
а б
Рис. 2.8. Изотермы Ван-дер-Ваальса (а);
фазовая диаграмма вещества (б)
При T € Tкуравнению Ван-дер-Ваальса соответствует кривая 1–2–3–4–5–6–7. Участок 6–7 соответствует газооб- разной фазе, участок 1–2 – жидкой фазе. Фаза вещества – макроскопическое физически однородное равновесное со- стояние вещества. Например, вода может находиться в паро- образной (П), жидкой (Ж) или твердой фазе. На участке 2–3– 4–5–6 соответствует равновесному состоянию жидкости и пара (Ж + П). В этом случае пар называется насыщенным, т.е. число молекул жидкости, покидающих поверхность пара равно число молекул пара, возвращающихся обратно в жид- кость. Ненасыщенный пар – пар, в котором число вылетаю- щих молекул превышает число возвращающихся.
Для наглядного изображения фазовых превращений ис- пользуется диаграмма состояния, на которой в координатах (PT) задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плав- ления (КП) и сублимации (КС), разделяющих поле диаграм- мы на три области, соответствующие условиям существова- ния твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Фазо- вый переход – изменение состояния вещества, связанное с переходом из одной фазы у другой.
Кривые рис. 2.8, б называются кривыми фазового равно- весия, каждая точка на них соответствует условиям равнове- сия двух сосуществующих фаз. Диаграмма состояния позво- ляет судить, в каком состоянии находится данное вещество при определенных макропараметрах P и T, а также какие фа- зовые переходы будут происходить в том или ином процессе. Тройной точкой называется точка, в которой пересека- ются кривые фазового равновесия и которая, следовательно, определяет условия одновременного равновесного сосуще- ствования трех фаз вещества. Тройная точка воды соответст- вует температуре 273.16 К (или 0.01ºC) и является основной реперной точкой для построения термодинамической темпе-
ратурной шкалы.
 2015-01-21
2015-01-21 3226
3226
