Ферменты этого класса катализируют реакции окисления-восстановления, участвуют в биологическом окислении (тканевом дыхании). Окисление (дегидрирование) – процесс отнятия атомов Н (Н+е-) от субстрата. Восстановление – процесс присоединения атомов Н (Н+е-) к акцептору.
Оксидоредуктазы образуют системы (цепи) дыхательных ферментов, в которых осуществляется многоступенчатый перенос атомов Н (или Н+, е-) от субстрата к акцептору. Конечным акцептором Н в клетках как правило является О2, в результате образуется Н2О.
В природных объектах обнаружено более 500 оксидоредуктаз. Это Д.К.Ф. Они отличаются коферментом и апоферментом. К ним относятся: дегидрогеназы, флавопротеины, цитохромы, пероксидаза, каталаза.
а) Дегидрогеназы – Д.К.Ф. Кофермент НАД или НАДФ. Это первичные дегидрогеназы – осуществляют отнятие Н от окисляемого субстрата
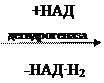 | |||||||||||
| CH3 | — | CH | — | COOH | CH3 | — | C | — | COOH | ||
| | | || | ||||||||||
| OH | O | ||||||||||
| молочная кислота | ПВК |
б) Флавиновые ферменты – Д.К.Ф. Их кофермент – рибофлавин – ФАД, ФМН (Вит.В2). Их функция – перенос Н от восстановленных форм дегидрогеназ (НАД.Н2 и НАДФ.Н2) к цитохромам, т.е. они – вторичные дегидрогеназы.
В) Цитохромы – Д.К.Ф. Их коферменты – гем (Fe+2). Их несколько типов, отличаются апоферментом. Сейчас известно несколько десятков цитохромов, их обозначают латинскими буквами: а1, а2, а3, b1, b2, b3, c, d…
Цитохромы способны переносить только е-, снятые с Н от флавопротеинов. Они переносят е- на О и его ионизируют, последний, соединяясь с Н+, образует Н2О. Из всех цитохромов только а3 передает е-на О2. Он называется цитохромоксидаза (он в геме кроме Fe2+ содержит также Cu2+).
Г) Пероксидазы (каталаза) – Д.К.Ф. Кофермент – гем (Fe3+).Отличаются апоферментом. Различие в функциях пероксидазы и каталазы объясняется разницей белковой части. Субстрат их действия – пероксид водорода:
пероксидаза
 Н2О2 2 Н2О + О
Н2О2 2 Н2О + О
каталаза
 2 Н2О2 2 Н2О + О2
2 Н2О2 2 Н2О + О2
Каталаза и пероксидаза содержатся в тканях животных, в молоке, крови, много в растениях.
2. Трансферазы. Ускоряют перенос групп атомов от одной молекулы к другой. В зависимости от того, какую группу они переносят, различают: аминотрансферазы, фосфотрансферазы, метилтрансферазы, ацилтрансферазы, гликозилтрансферазы.
а) Аминотрансфераза
| COOH | COOH | |||||||||||||||
| COOH | | | COOH | | | |||||||||||||
| | |  C C | O |
| | | CH | — | NH2 | |||||||||
| CH | — | NH2 | + | | |  |  C C | O | + | | | |||||||
| | | CH2 | | | CH2 | |||||||||||||
| CH3 | | | CH3 | | | |||||||||||||
| COOH | COOH | |||||||||||||||
| аланин | щавелево- | ПВК | аспарагиновая кислота | |||||||||||||
| уксусная кислота |
фосфотрансфераза
 б) АТФ + глюкоза АДФ + глюкозо-6-фосфат
б) АТФ + глюкоза АДФ + глюкозо-6-фосфат
(гексокиназа)
- n АДФ
Метилтрансферазы – переносят -СН3; ацилтрансферазы – ацильные остатки жирных кислот; гликозилтрансферазы – гликозильные остатки при синтезе олиго- и полисахаридов.
3. Гидролазы. Ферменты ускоряют реакции гидролиза, то есть распад веществ (кроме С-С- связей) при участии воды. Сюда относятся: эстеразы, глюкозидазы, пептидазы, амидазы, фосфатазы.
а) Гидролиз жира
 | O | |||||||||||||||||
| CH2 | — | O | — | C | — | R1 | CH2 | — | OH | |||||||||
| | |  | O |
| | | ||||||||||||||
| CH | — | O | — | C | — | R2 | + | H2O |  | CH | — | OH | + | 3R | — | COOH | ||
| | |  | O | | | |||||||||||||||
| CH2 | — | O | — | C | — | R3 | CH2 | — | OH | |||||||||
| жир | глицерин | жирная к-та | ||||||||||||||||
б) Гидролиз углеводов
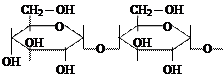 | 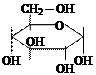 | |||||||
| ||||||||
| … | + | H2O |  | n | ||||
| крахмал | α-глюкоза |
в) Гидролиз белка
| O |  | H |  O O | H | |||||||||||||||||||||||
| || | | | || | | |
| |||||||||||||||||||||||
| NH2 | — | CH | — | C | — | N | — | CH | — | C | — | N | — | CH | — | COOH | + |  H2O H2O | n+2 | NH2 | — | CH | — | COOH | |||
| | | | | | | | | ||||||||||||||||||||||||
| R | R |
| R | R |
4. Лиазы. Ферменты этого класса ускоряют реакции распада по связям С–С; С–N; С–О без участия воды.
а) декарбоксилазы аминокислот:
 СН3-СН-СООН СН3-СН2-NН2 + СО2
СН3-СН-СООН СН3-СН2-NН2 + СО2
| этиламин
NH2 ала
б) декарбоксилазы кетокислот:
 СН3-С-СООН СН3-С=О + СО2
СН3-С-СООН СН3-С=О + СО2
|| уксусный \
О ПВК альдегид Н
в) альдолаза
| CH2—O—P | P | фосфодиоксиацетон | |||||||||||
| | | | | (ФДОА) | |||||||||||
| HO | — | C |  | O | O | OH | |||||||
| | | | | || | | | ||||||||||
| HO | — | C | — | H | 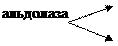 | C | — | C | — | CH2 | |||
| | |  | ||||||||||||
| H | — | C | — | OH | CH2 | — | CH | — | C | — | H | ||
| | | | | | | || | ||||||||||
| H | — | C | O | OH | O | ||||||||
| | | | | (3-ФГА) | |||||||||||
| CH2—O—P | P | 3-фосфоглицериновый альдегид | |||||||||||
| фруктозо-1,6-дифосфат |
г) аспартат-аммиак-лиаза
СООН СООН
| |
CH-NH2 CH + NH3
 | ||
| ||
CH2 CH
| |
COOH COOH
Аспарагиновая к-та фумарат
5. Изомеразы. Ускоряют структурные изменения в пределах одной молекулы.
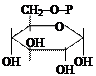 |  | 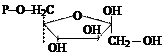 |
| глюкозо-6-фосфат | фруктозо-6-фосфат |
2) Лигазы (синтетазы). Ускоряют реакции синтеза веществ за счёт энергии АТФ.
а) Синтез аспарагина (амида аспарагиновой кислоты)
| NH2 | — | CH | — | COOH | NH2 | — | CH | — | COOH | |||||
| | |
| | | ||||||||||||
| CH2 | + | NH3 |
| CH2 | ||||||||||
| | |
 | | | ||||||||||||
| OH | — | C | = | O | NH2 | — | C | = | O | |||||
| аспарагиновая кислота | аспарагин |
б) Синтез глутамина (амида глутаминовой кислоты)
| NH2 | — | CH | — | COOH |  | NH2 | — | CH | — | COOH | ||
| | | | | |||||||||||
| (CH2)2 | + | NH3 | (CH2)2 | |||||||||
| | | | | |||||||||||
| OH | — | C | = | O | NH2 | — | C | = | O | |||
| глутаминовая кислота | глутамин |
 2015-02-27
2015-02-27 1869
1869








