| тиоламин | — | пантотеновая кислота | — | аденозиндифосфат |
| (B3) |
У ОКФ роль активного центра выполняет часть белковой молекулы. Это уникальное сочетание определенных аминокислот. Активный центр возникает в тот момент, когда белок-фермент приобретает определенную специфическую 3-ю структуру. Чаще в активный центр входят аминокислоты: сер, гис, асп, глу, арг, цис, тир, три. Они располагаются в разных точках полипептидной цепи и оказываются поблизости (в одной области) при складывании цепи.
Кроме активного центра у ферментов различают ещё 2 центра: субстратный и аллостерический.
Субстратный центр – участок молекулы фермента, ответственный за присоединение субстрата. Здесь аминокислоты: лиз, глу, цис.
Аллостерический центр – участок молекулы фермента, при присоединении к которому низкомолекулярного вещества изменяется 3-я структура. А, следовательно – каталитическая активность фермента.
2-й вопрос.
Ферменты – биокатализаторы, по ряду признаков отличаются от неорганических катализаторов, хотя они, как и неорганические катализаторы, не вызывают новых реакций, а лишь ускоряют существующие.
1. Интенсивность действия. Ферменты в отличие от неорганических катализаторов работают очень интенсивно.
Пример: а) кислотный гидролиз белка идет при t о 100оС за несколько часов;
б) ферментативный гидролиз белка идет при t о 40о за несколько минут;
а) кислотный гидролиз крахмала проходит при tо 100о за несколько часов;
б) ферментативный гидролиз крахмала проходит при tо 40о за несколько секунд.
2. Ферменты обладают специфичностью действия. Каждый фермент ускоряет одну реакцию или реакции одного типа.
Пример: каталаза – только распад Н2О2; амилаза – гидролиз крахмала; дегидрогеназа – реакции окисления, т.е. отделения Н2.
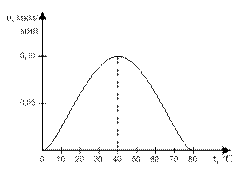
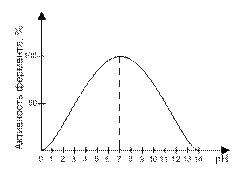
3. Ферменты работают в мягких условиях (низкая температура, нормальное давление, невысокое значение pH-среды). В этом правиле есть и исключения. Каталаза работает при температуре от 0°С до 10°С, а миокиназа – до 100°С. Пепсин работает при pH среды от 1,5 до 2, а аргиназа – до 9,9.
|
|
4. На активность ферментов влияют активаторы и ингибиторы. Например, NaCl активирует фермент амилазу:
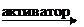 | ||||||
| NaCl |  амилаза амилаза | гидролизует | крахмал | |||
| ||||||
  |  | |||||
| HCl | пепсин | гидролизует | белок | |||
 | ||||||
| желчь | липаза | гидролизует | жир |
5. Все процессы ферментативного катализатора представляют собой серию превращений, многоступенчатый процесс. Жесткая запрограммированность этапов действия – вот что отличает биокатализаторы от неорганических катализаторов.
3-й вопрос.
Ферменты, переваривающие белок пищи, – протеолитические: пепсин, трипсин, химотрипсин. Они вырабатываются в неактивной форме – проферменты (зимогены). Затем при определенных условиях превращаются в активные. Поэтому вырабатывающие их ткани не подвергаются самоперевариванию.
Н+ (НCl)
 Пепсиноген пепсин + полипептид
Пепсиноген пепсин + полипептид
М = 42 000 (в полости М = 35 000 М = 7 000
(в стенке желудка) желудка) (он блокировал акт.центр)
энтерокиназа
 трипсиноген трипсин + гексапептид
трипсиноген трипсин + гексапептид
(в поджелудочной (в тонком изменение (вал, 4асп, лиз)
железе) кишечнике) 3-й стр-ры
трипсин
 химотрипсиноген химотрипсин
химотрипсиноген химотрипсин
(в тонком кишечнике)
 | |||||
 | |||||
| NH2 |  | COOH | |||
Эти ферменты обладают специфичностью действия (выборочный, селективный характер действия). Они ускоряют гидролиз пептидных связей в молекуле белка между определенными аминокислотами:
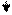
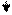
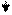 Пепсин трипсин химотрипсин
Пепсин трипсин химотрипсин
-фен – лей - - арг – лиз - - фен – тир – три –
У растений фермент папаин гидролизует связи, образованные аминокислотами: арг, лиз, фен.
4-й вопрос.
Из известных более 2500 ферментов каждый имеет свое название.
1. Тривиальная номенклатура. Имена ферментам давали по случайным признакам. Например, «пепсин» – «разжижаю», «трипсин» – «перевариваю».
2. Рациональная номенклатура. Названия ферментам стали давать по названию субстрата действия данного фермента с добавлением окончанием «-аза». Например, сахароза (субстрат) – сахараза (фермент), лактоза – лактаза, крахмал – амилаза.
3. Систематическая номенклатура. Название ферменту давали по типу катализируемой реакции.
а) Д егидрогеназа – фермент, отделяющий водород, то есть происходит окисление.
| COOH | COOH | |||||
| | | 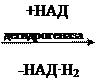 | | | ||||
| CH2 | CH | |||||
| | | || | |||||
| CH2 | CH | |||||
| | | | | |||||
| COOH | COOH | |||||
| янтарная кислота (сукцин) | фумаровая кислота (фумарат) | |||||
б) Декарбоксилаза – фермент, отделяющий карбоксильную группу.
| O | ||||||||||
| CH3 | — | C | — | COOH | 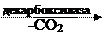 | || | ||||
| || | CH3 | — | C | |||||||
| O | | | |||||||||
| H | ||||||||||
| ПВК (пируват) | альдегид уксусной кислоты |
4. Научная номенклатура. Она была принята в 1961 году на пятом Международном биохимическом конгрессе. То есть в названии фермента указывается субстрат, акцептор и тип катализируемой реакции. Например, α-аланин-α-кетоглутарат-аминотрансфераза:
| COOH | COOH | |||||||||||
| | | | | |||||||||||
| COOH | αC = O | COOH | CH — NH2 | |||||||||
| | | | |
| | | | | ||||||||
| αCH | — | NH2 | + | CH2 |  |  C C | O | + | CH2 | |||
| | | | | | | | | |||||||||
| βCH3 | CH2 | CH3 | CH2 | |||||||||
| | | | | |||||||||||
| COOH | COOH | |||||||||||
| α-аланин | α-кетоглутарат | ПВК | глутаминовая к-та |
На этом же конгрессе была принята классификация ферментов, согласно которой все ферменты делят на шесть классов. Составлен общий список известных ферментов. Каждому ферменту в этом списке дан индивидуальный номер (шифр). Примеры: уреаза – 3.5.1.5; лактатдегидрогеназа – 1.1.1.27.
 2015-02-27
2015-02-27 5569
5569








