Небольшая часть молекул воды всегда находится в ионном состоянии, хотя это очень слабый электролит. Ионизация и дальнейшая диссоциация воды, как уже говорилось, описывается уравнением протолитической реакции кислотно-основного диспропорционирования или автопротолиза.
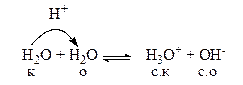 |
Вода – очень слабый электролит, следовательно, образующиеся сопряженная кислота и сопряженное основание являются сильными. Поэтому равновесие этой протолитической реакции смещено влево.
Константа этого равновесия Кравн = 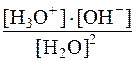
Количественная величина произведения концентрации ионов воды [H3O+]×[OH –] есть ионное произведение воды.
Оно равно: [H3O+]×[OH –] = Кравн. × [H2O]2 = 1×10 – 14
Следовательно: КН2О = [H3O+]×[OH –] = 10 – 14
или упрощенно КН2О = [H+]×[OH –] = 10 – 14
КН2О – ионное произведение воды, константа автопротолиза воды или просто константа воды. КН2О зависит от температуры. При повышении t°С она увеличивается.
В химически чистой воде [H+] = [OH –] = 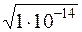 = 1×10 – 7. Это нейтральная среда.
= 1×10 – 7. Это нейтральная среда.
В растворе может быть [H+] > [OH –] – среда кислая или [H+] < [OH –] – среда щелочная
[H+] = 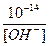 ; [OH –] =
; [OH –] = 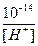
 2015-02-27
2015-02-27 7941
7941








