Удобно решать эту задачу с использованием таблицы, в которую записываются: С 0 – начальные концентрации веществ; C – концентрации веществ в момент, когда в реакционной смеси останется 40 % вещества А, что составляет 6 ∙ 0,4 = 2,4 моль/л; DС – изменение концентрации в процессе реакций, что для вещества А составляет (6 – 2,4) = 3,6 моль/л. Из уравнения реакции видно, что вещества А и В взаимодействуют в соотношении 2: 1, поэтому концентрация В уменьшилась на (3,6: 2) = 1,8 моль/л и стала равной (3 – 1,8) = 1,2 моль/л.
| Концентрация | Вещества | |
| А | В | |
| С 0 | ||
| DС | 3,6 | 1,8 |
| C | 2,4 | 1,2 |
Запишем закон действующих масс для данной реакции:
ν = k [ A ] 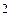 [ B ].
[ B ].
На основании найденных начальных и конечных концентраций рассчитываем скорости реакции:
ν 0 = 0,6 × 62 × 3 = 64,8 моль/л×с, ν = 0,6 × 2,42 × 1,2 = 4,15 моль/л×с.
Результаты расчета показывают, что скорость реакции с течением времени уменьшается, так как вещества расходуются в процессе реакции.
С увеличением температуры в реакционной системе интенсивность теплового движения частиц реагентов, вступающих в реакцию, увеличивается. Поэтому растет и число столкновений между ними в единицу времени, в том числе и таких столкновений, которые благоприятны для протекания химической реакции. Отсюда следует, что с ростом температуры в реакционной среде скорость химической реакции всегда увеличивается. В простейшем виде увеличение скорости реакции в зависимости от температуры дается правилом Вант-Гоффа, которое он установил эмпирически. Это правило формулируется так: с ростом температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 – 4 раза и записывается с помощью формулы (3.6):
|
|
|
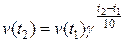 , ,
| (3.6) |
где 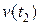 и
и 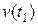 – скорости химической реакции при температурах
– скорости химической реакции при температурах 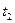 и
и 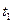 соответственно; g – температурный коэффициент реакции, принимающий значения от 2 до 4 в зависимости от природы реагентов.
соответственно; g – температурный коэффициент реакции, принимающий значения от 2 до 4 в зависимости от природы реагентов.
Как видно из уравнения (3.6), скорость реакции сильно изменяется в зависимости от температуры, так как эта зависимость является степенной.
Пример 3. Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 70 ˚С, если температурный коэффициент равен 2?
 2015-02-27
2015-02-27 607
607








