Катализаторами называются вещества, которые не входят в конечные продукты реакции, химически не изменяются и не расходуются, но изменяют скорость химических реакций. Катализаторы позволяют изменять скорость химической реакции, не изменяя температуру системы. Одни катализаторы сильно ускоряют реакции (положительный катализ), другие, напротив, замедляют реакции (отрицательный катализ). Различают гомогенный и гетерогенный катализы. При гомогенном катализе реагенты и катализатор находятся в одной фазе (жидкость или газ), при гетерогенном – в различных фазах (обычно катализатор твердый). Вне зависимости от вида катализа, реакции при участии катализатора протекают через образование промежуточного комплекса с катализатором, и роль катализатора в том, что образование этого комплекса приводит к снижению или повышению энергии активации. В результате, в силу экспоненциальной зависимости (3.7), скорость реакции резко возрастает или, напротив – убывает.
Действие катализатора избирательно. Подбирая катализаторы, можно из одного и того же вещества получать совершенно различные продукты. Для каждой реакции имеется свой катализатор. Часто в качестве катализаторов применяют твердые вещества: платину, палладий, железо, натрий, калий; оксиды Al2O3, MnO2, Cr2O3; активированный уголь, силикагель и другие.
Катализ имеет огромное значение в хозяйственной деятельности человека и в природе. Одни катализаторы направляют химический синтез веществ с заданными свойствами, другие (ингибиторы) – предотвращают нежелательные реакции разрушения деталей машин, зданий, сооружений и самых различных материалов. Область применения катализаторов в современных технологиях просто необозрима. Производство аммиака, азотной и серной кислот, формальдегида, этилена, ацетилена, спиртов, каучука и многих технически важных полимеров является каталитическими процессами. Крекинг и реформинг нефтепродуктов – многотоннажные каталитические процессы. Жизнедеятельность организмов любого уровня сложности сопровождается процессами ферментативного катализа. Ферменты – биологические катализаторы белковой природы, обладающие исключительно эффективным и селективным действием.
Задачи
51 Реакция идет по уравнению A (Г) + 2 B (Г) ® C (Г). Как изменится скорость реакции, если давление увеличить в 3 раза и одновременно повысить температуру на 30 ˚С? Температурный коэффициент скорости реакции равен 3.
Ответ: увеличится в 729 раз.
52 Реакция протекает по уравнению 2 A (Г) + B (Г) ® 2 C (Г). Как изменится скорость реакции при уменьшении давления в системе в 2 раза и одновременном понижении температуры на 40 ˚С? Температурный коэффициент скорости равен 2.
Ответ: уменьшится в 128 раз.
53 Скорость реакции возросла в 243 раза, температурный коэффициент равен 3. На сколько градусов была повышена температура?
Ответ: на 50 ˚С.
54 Скорость реакции возросла в 100 раз. Температурный коэффициент равен 2,5. На сколько градусов была повышена температура?
Ответ: на 50 ˚С.
55 При повышении температуры на 50 ˚С скорость реакции возросла в 32 раза. Вычислите температурный коэффициент скорости реакции.
Ответ: γ = 2.
56 При понижении температуры на 45 ˚С реакция замедлилась в 35 раз. Определите температурный коэффициент скорости реакции.
Ответ: γ = 2,2.
57 Реакция протекает по уравнению N2 + 3H2 Á 2NH3. Как изменится скорость реакции, если концентрацию азота увеличить в 4 раза, а концентрацию водорода – в 2 раза?
Ответ: возрастет в 32 раза.
58 Реакция протекает по уравнению 2 A + B ® C. Начальные концентрации реагирующих веществ (моль/л): CA = 0,8, CB = 0,6. Как изменится скорость реакции, если концентрацию вещества В увеличить до 0,9, а вещества А до 1,2 моль/л?
Ответ: возрастет в 3,4 раза.
59 Реакция протекает по уравнению 2 A + B ® C. Начальные концентрации реагирующих веществ (моль/л): CA = 2,5, CB = 8. Как изменится скорость реакции, если концентрацию вещества А уменьшить до 1,5, а вещества В до 4 моль/л?
Ответ: уменьшится в 5,6 раза.
60 Разложение N2O протекает по уравнению 2N2O = 2N2 + O2. Константа скорости равна 5×10–4 л/моль×мин. По истечении некоторого времени концентрация N2O стала равной 3 моль/л. Сколько процентов N2O разложилось, если отношение конечной скорости к начальной равно 0,36? Какова начальная скорость реакции?
Ответ: 40 %; 0,0125 моль/л×мин.
61 Омыление этилацетата описывается следующим уравнением CH3COOC2H5 + NaOH Á CH3COONa + C2H5OH. Начальная концентрация эфира 0,02 моль/л, щелочи 0,1 моль/л. По истечении некоторого времени прореагировало 75 % эфира, и скорость реакции стала равной 4,25×10–5 моль/л×мин. Вычислить начальную скорость реакции.
Ответ: 2×10–4 моль/л×мин.
62 Реакция между веществами А и В выражается следующим уравнением 2 A + B ® C. Константа скорости равна 0,7 л2/моль2×мин. Начальная концентрация вещества В равна 0,6 моль/л. После того как прореагировало 40 % вещества А, его концентрация стала равной 0,3 моль/л. Найдите начальную скорость и скорость реакции в тот момент, когда прореагирует 40 % вещества А.
Ответ: 0,105; 0,0315 моль/л×с.
63 Реакция между веществами А и В протекает по следующему уравнению 2 A + B ® C. Начальные концентрации реагирующих веществ (моль/л): CA = 6, CB = 5. Константа скорости реакции равна 0,5 л2/моль2×c. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в системе останется 45 % вещества В.
Ответ: 90; 0,28 моль/л×c.
64–67 Константа скорости реакции при t1 ˚C равна k1, при t2 ˚C – k2. Энергия активации равна Ea, кДж/моль. Вычислить величины, обозначенные вопросом.
| № задачи | t1, ˚C | k1 | t2, ˚C | k2 | 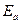 , кДж/моль , кДж/моль | Ответ |
| 0,02 | ? | 0,19 с–1 | ||||
| 0,03 | 0,4 | ? | 67,9 кДж/моль | |||
| 4×10–5 | 7,7×10–5 | ? | 59,4 кДж/моль | |||
| 2×10–3 | ? | 103,5 | 4,7×10–4с–1 |
68–70 Рассчитайте, во сколько раз изменится константа скорости реакции при увеличении температуры от t1 ˚C до t2 ˚C, если энергия активации равна 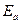 , кДж/моль.
, кДж/моль.
| № задачи | t1, ˚C | t2, ˚C | Ea, кДж/моль | Ответ |
| 95,6 | 10 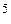 | |||
| 180,2 | 10 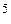 | |||
| 38,2 | 10 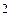 |
71 Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2 A (Г) + 3 B (Г) Á 2 C (Г) при увеличении давления в 2 раза?
Ответ: в 8 раз.
72 В системе 2 A + B ® C концентрацию А увеличили от 0,03 до 0,12 моль/л, а концентрацию В – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Ответ: в 48 раз.
73 Реакция протекает по уравнению H2(Г) + I2(Г) Á 2HI(Г). Константа скорости реакции равна 0,16 моль/л. Начальные концентрации веществ были (моль/л): С 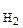 = 0,04, С
= 0,04, С 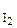 = 0,05. Вычислите начальную скорость реакции и ее скорость, когда С
= 0,05. Вычислите начальную скорость реакции и ее скорость, когда С 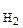 стала равной 0,03 моль/л.
стала равной 0,03 моль/л.
Ответ: 3,2×10–4; 1,9×10–4 моль/л×c.
74 Реакция протекает по уравнению A + B ® C. Начальные концентрации веществ A = 0,1 моль/л, В = 0,1 моль/л. Через некоторое время концентрация вещества А стала равной 0,04 моль/л. Во сколько раз уменьшится скорость реакции?
Ответ: в 6,25 раза.
75 Реакция идет по уравнению A + 2 B ® C. Константа скорости равна 0,4 л2/моль2с, а начальные концентрации (моль/л): CА = 0,3, CВ = 0,5. Вычислите скорость реакции в начальный момент и после того, как прореагирует 0,1 моль/л вещества А.
Ответ: 0,03; 0,0072 моль/л×c.
76 Реакция протекает по уравнению 3H2 + N2 Á 2NH3. Скорость реакции увеличилась в первом случае в 216 раз в результате увеличения концентрации H2, а во втором в 256 раз в результате повышения давления. Во сколько раз были увеличены концентрация H2 и давление?
Ответ: в 6 и 4 раза.
77 Реакция протекает по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5×10–4л/моль×мин. Начальная концентрация N2O равна 3,2 моль/л. Вычислите скорость реакции в начальный момент и в тот момент, когда разложится 25 % N2O.
Ответ: 5,12×10–3; 28,8×10–4 моль/л×мин.
78 Реакция протекает по уравнению на A (Г) + 2 B (Г) ® C (Г). Как изменится скорость реакции при уменьшении давления в системе в 4 раза и одновременном понижении температуры на 20 ˚C? Температурный коэффициент скорости равен 3.
Ответ: уменьшится в 576 раз.
79 Вычислите константу скорости реакции 2 A + B ® C, если при концентрациях А и В, равных соответственно 0,5 и 0,6 моль/л, ее скорость составляет 0,018 моль/л×мин.
Ответ: 0,12 л2/моль2мин.
80 Реакция протекает по уравнению 2NO + O2 Á 2NO. Начальные концентрации веществ равны (моль/л); C 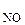 = 0,03, C
= 0,03, C 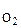 = 0,05. Как изменится скорость реакции вследствие увеличения концентрации кислорода до 0,1, а оксида азота до 0,06 моль/л?
= 0,05. Как изменится скорость реакции вследствие увеличения концентрации кислорода до 0,1, а оксида азота до 0,06 моль/л?
Ответ: увеличится в 8 раз.
 2015-02-27
2015-02-27 1831
1831
