Составляем таблицу изменения концентраций, в которую вносим из условия задачи равновесные концентрации. Определяем константу равновесия этой реакции
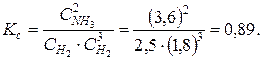
Поскольку в начальный момент времени аммиака не было, то в ходе реакции изменение его концентрации составило 3,6 моля. Изменение концентраций Δ С участников равновесия пропорционально коэффициентам в уравнении реакции.
| Концентрации | Вещества | ||
| H2 | N2 | NH3 | |
| C0 | 7,2 | 4,3 | |
| ∆ C | 5,4 | 1,8 | 3,6 |
| C | 1,8 | 2,5 | 3,6 |
Исходные концентрации азота и водорода находим путем сложения равновесных концентраций с их изменениями в ходе реакции.
Пример 3. Химическое равновесие реакции CO2 + H2 Á CO + H2O в газовой фазе установилось при следующих концентрациях реагирующих веществ (моль/л): 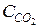 = 7,
= 7, 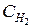 = 5,
= 5, 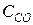 = 10,
= 10, 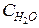 = 14. Равновесие системы было нарушено из-за уменьшения концентрации H2O до 11 моль/л. Вычислить новые равновесные концентрации реагирующих веществ (С’) после смещения равновесия.
= 14. Равновесие системы было нарушено из-за уменьшения концентрации H2O до 11 моль/л. Вычислить новые равновесные концентрации реагирующих веществ (С’) после смещения равновесия.
 2015-02-27
2015-02-27 570
570







