Окислительно-восстановительными реакциями (ОВР) называют такие реакции, в ходе которых одни частицы (атомы, молекулы или ионы) отдают электроны, а другие частицы их присоединяют. При этом происходит изменение степени окисления атомов элементов, входящих в состав указанных частиц.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом.
Для составления электронных балансов окислительно-восстановительных реакций используют понятие «степень окисления атома».
Степенью окисления называется условный заряд атома, входящего в состав молекулы или иона, вычисленный в предположении, что все его химические связи с ближайшими соседними атомами являются ионными, то есть электронные пары полностью смещены в сторону более электроотрицательного атома [3].
Степени окисления атомов простых веществ считаются равными нулю.
Например, степени окисления атомов элементов в уравнениях химических реакций:
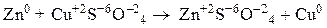
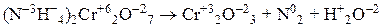
Окислитель, присоединяя электроны, восстанавливается и понижает свою степень окисления.
Восстановитель, отдавая электроны, окисляется и повышает свою степень окисления.
Например:
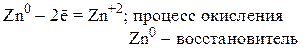
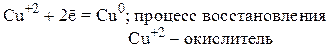
Важнейшими восстановителями являются:
1) металлы и некоторые неметаллы (Zn, Al, Cr, H2, C, S) в виде простых веществ:
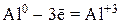
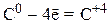
2) анионы бескислородных кислот (Br–, I–, S2–) и их солей:
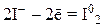
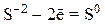
3) катионы металлов в низшей или промежуточной степенях окисления (Fe+2, Mn+2, Cr+2), входящие в состав оксидов, оснований и солей:
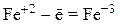
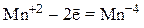
4) анионы кислородсодержащих кислот, в которых атом неметалла имеет промежуточную степень окисления (NO–2, SO2–3):
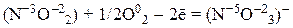
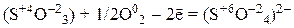
Важнейшими окислителями являются:
1) галогены (F2, Cl2, Br2, I2), кислород и другие неметаллы в свободном состоянии:
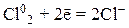
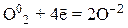
2) азотная кислота HNO3, разбавленная и концентрированная, окислительные свойства которой представлены в таблице 8.1:
Таблица 8.1
| Окислитель HNO3 | Восстановитель | Продукты восстановления HNO3 | Примечания |
| Концентрированная | Неактивные металлы (Cu, Ag, Hg) | 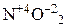 | HNO3 не действует на Fe, Al, Cr, Au, Pt (пассивирование металлов) |
| Активные металлы (Zn, Mg, Ca …) | 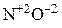 | ||
| Неметаллы (S, C, P, Si …) | 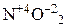 | ||
| Окончание табл. 8.1 | |||
| Разбавленная | Неактивные металлы (Cu, Ag, Hg) | 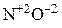 | |
| Активные металлы (Zn, Mg, Fe, Al…) | 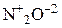 или или 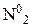 | Щелочные металлы сначала реагируют с Н2О в разбавленной HNO3 | |
| Неметаллы (S, C, P, Si …) | 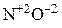 | ||
| Сильноразбавленная | Активные металлы (Zn, Mg, Fe, Al …) | 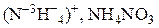 |
3) серная кислота H2SO4 концентрированная, окислительные свойства которой представлены в таблице 8.2:
Таблица 8.2
| Восстановитель | Продукт восстановления H2SO4 | Примечание |
| Неактивные металлы (Cu, Ag, Hg) | 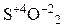 | Нагревание |
| Активные металлы (Zn, Mg, Ca …) | 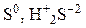 | Практически при взаимодействии H2SO4(конц.) с активными металлами образуются все вещества – SO2, S, H2S, но доля каждого из них зависит от условий реакции |
| Неметаллы (S, C, P, Si …) | 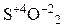 | Нагревание |
4) сложные анионы, образованные металлами в высшей степени окисления, например: MnO4– (KMnO4); Cr2O72– (K2Cr2O7);
5) перманганат калия KMnO4, продукты восстановления которого зависят от характера среды:
– в кислой среде:
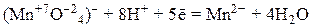
– в нейтральной среде:
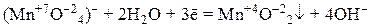
– в щелочной среде:
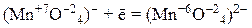
6) дихромат калия K2Cr2O7 используют как окислитель в кислой среде:
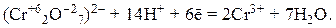
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций можно осуществить с помощью метода электронного баланса, согласно которому число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Рассмотрим алгоритм нахождения коэффициентов в уравнениях окислительно-восстановительных реакций на примере реакции:
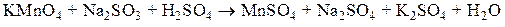
1) Вычислим степени окисления атомов всех элементов и определим те элементы, атомы которых изменили свои степени окисления:
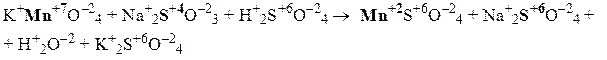
2) Находим окислитель и восстановитель в данной окислительно-восстановительной реакции и запишем схемы полуреакций окисления и восстановления:
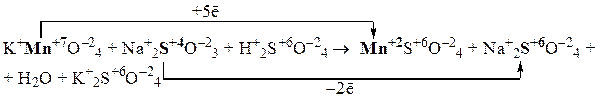
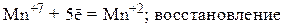
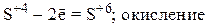
3) Уравниваем число частиц каждого элемента в левой и правой частях полуреакций (в данном случае они уравнены) и уравниваем число принятых и отданных электронов, подбирая соответствующие множители для обеих полуреакций. Так как марганец принимает 5 электронов, а сера отдает 2 электрона, то наименьшее общее кратное этих чисел равно 10. Разделив 10 на число электронов, участвующих в полуреакциях, получаем соответствующие множители для обеих стадий:
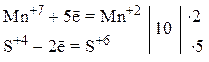
4) С учетом подобранных множителей складываем левые и правые части уравнений обеих полуреакций и записываем полное уравнение электронного баланса:
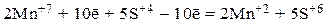
или, после приведения подобных членов (+10ē и –10ē),
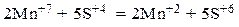
5) Подобранные коэффициенты переносим в молекулярное уравнение:
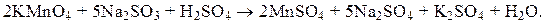
6) Теперь уравниваем число атомов каждого элемента в левой и правой частях реакции, начиная с атомов металлов, и проводим проверку баланса по водороду и кислороду.
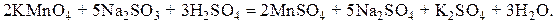
Рассмотрим несколько примеров составления уравнений окислительно-восстановительных реакций.
 2015-02-27
2015-02-27 1400
1400
