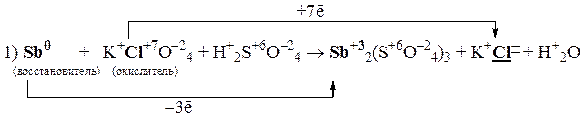
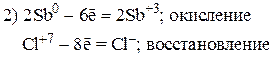
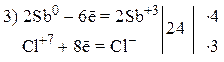
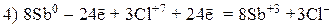
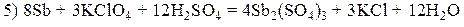
Пример 2
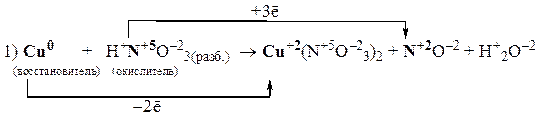
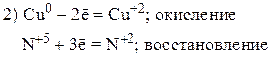
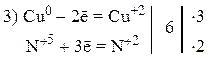
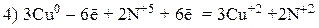
Так как из уравнения видно, что HNO3 (разб.) является не только окислителем, но и расходуется на образование нитрата меди, то коэффициент перед HNO3 (разб.) подбираем с учетом числа атомов азота в Cu(NO3)2
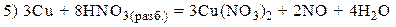
Пример 3
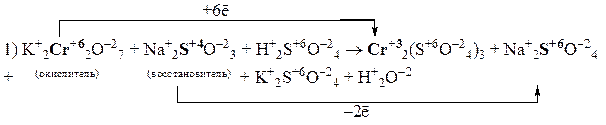
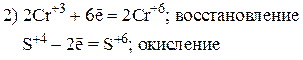
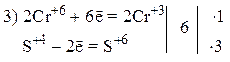
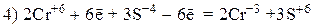
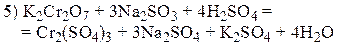
Пример 4
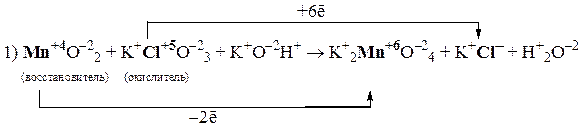
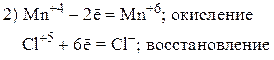
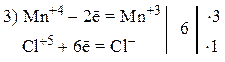
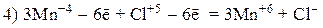
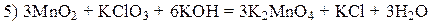
Задачи
Расставьте коэффициенты в уравнениях окислительно-восстановительных реакций. Укажите окислитель и восстановитель, запишите стадии окисления и восстановления.
201 Bi + HNO3(разб.) ® Bi(NO3)3 + NO + H2O
202 KMnO4 + KNO2 + H2O ® MnO2 + KNO3 + KOH
203 PbO2 + MnSO4 + H2SO4 ® PbSO4 + HMnO4 + H2O
204 MnO2 + Br2 + KOH ® K2MnO4 + KBr + H2O
205 Cr2(SO4)3 + KOH + Cl2 ® K2CrO4 + KCl + K2SO4 + H2O
206 SnCl2 + K2Cr2O7 + H2SO4 ® Sn(SO4)2 + CrCl3 + K2SO4 + H2O
207 SO2 + KMnO4 + KOH ® K2SO4 + MnO2 + H2O
208 Cl2 + H2S + H2O ® HCl + H2SO4
209 I2 + Cl2 + H2O ® HIO3 + HCl
210 FeSO4 + HNO3 + H2SO4 ® Fe2(SO4)3 + NO + H2O
211 FeSO4 + HIO3 + H2SO4 ® Fe2(SO4)3 + I2 + H2O
212 MnSO4 + Br2 + KOH ® KMnO4 + KBr + K2SO4 + H2O
213 KI + Li2Cr2O7 + H2SO4 ® I2 + Cr2(SO4)3 + Li2SO4 + K2SO4 + H2O
214 C + K2Cr2O7 + H2SO4 ® CO2 + Cr2(SO4)3 + K2SO4 + H2O
215 Na3AsO3 + K2Cr2O7 + H2SO4 ® Na3AsO4 + Cr2(SO4)3 + K2SO4 +
+ H2O
216 PbS + HNO3 ® Pb(NO3)2 + S + NO + H2O
217 Mn(NO3)2 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + H2O
218 NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O
219 KCl + KMnO4 + H2SO4 ® Cl2 + MnSO4 + K2SO4 + H2O
220 Na2S + Na2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + Na2SO4 + H2O
 2015-02-27
2015-02-27 2401
2401








