8-оксихинолин (при pH 9-12) образует комплекс с магнием в виде жёлто-зелёного осадка - оксихинолинат магния, флуоресцирующий зелёным светом:
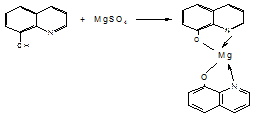
Бария хлорид – реактив используемый для открытия сульфат иона.
Исходя из результатов полученных реакций можно заключить, что данное вещество – магния сульфат.
Для обнаружения иона магния также используют общую реакцию образования нерастворимого в воде, но растворимого в уксусной кислоте белого кристаллического осадка фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли магния гидрофосфата динатрия и раствора аммиака:
NH4Cl
MgCl2 + Na2HPO4 + NH3 · H2О ¾¾¾ NH4MgPO4 + 2NaCl + H2O
NH4MgPO4 + 2CH3COOH ® Mg(CH3COO)2 + NH4H2PO4
К реакционной смеси необходимо прибавлять раствор хлорида аммония (до pH 9) во избежание образования в щелочной среде аморфного осадка гидроксида магния Mg(OH)2 (при pH > 10). Однако большой избыток хлорида аммония может препятствовать осаждению фосфата магния-аммония.
Ион магния в магния оксиде обнаруживают, осаждая его из растворов в хлороводородной кислоте избытком гидроксида натрия. Образующийся гидроксид магния - белый студенистый осадок, нерастворимый в избытке раствора гидроксида натрия. Если затем добавить несколько капель иода, то осадок приобретает темно-коричневую окраску.
|
|
|
Соединения магния количественно определяют прямым комплексонометрическим методом, индикатор кислотный хром черный специальный (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:
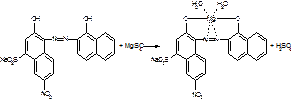 Титрант — 0,05 М раствор трилона Б (ЭДТАNa2) связывает находящиеся в растворе ионы магния в комплексное соединение:
Титрант — 0,05 М раствор трилона Б (ЭДТАNa2) связывает находящиеся в растворе ионы магния в комплексное соединение:
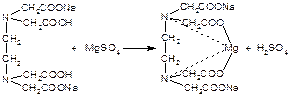
Так как выделяется серная кислота, для поддержания оптимального значения pH среды необходимо прибавлять аммиачный буферный раствор.
В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл — ЭДТА Na2, титрант вступает во взаимодействие с ионами магния, содержащимися в составе комплекса металл — индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение ЭДТА Na2 — металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая окраска раствора переходит в синюю окраску свободного индикатора:
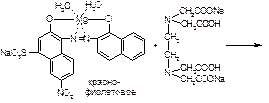
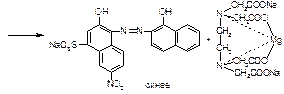
 2015-02-27
2015-02-27 3438
3438








