При образовании химической связи происходит перераспределение в пространстве электронных плотностей, первоначально принадлежавших разным атомам. Поскольку наименее прочно связаны с ядром электроны внешнего уровня, то этим электронам принадлежит главная роль в образовании химической связи. Количество химических связей, образованных данным атомом в соединении, называют валентностью. Электроны, принимающие участие в образовании химической связи, называются валентными. В зависимости от характера их распределения различают три основных типа химической связи: металлическую, ионную и ковалентную.
Ковалентная связь образуется парой электронов, принадлежащих двум атомам. При этом происходит перекрывание атомных орбиталей, повышение электронной плотности в пространстве между ядрами и их стягивание. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма (рис. 8), когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Ионная связь — частный случай ковалентной, когда образовавшаяся пара электронов полностью принадлежит одному из атомов, становящихся анионом (отрицательно заряженным ионом). Таким образом ионная связь – это связь между противоположно заряженными ионами, когда атомы одного элемента легко отдают внешний электрон (например, щелочные металлы), а атомы другого элемента присоединяют электрон (например атомы галогенов). Образующиеся ионы электростатически притягиваются друг к другу.
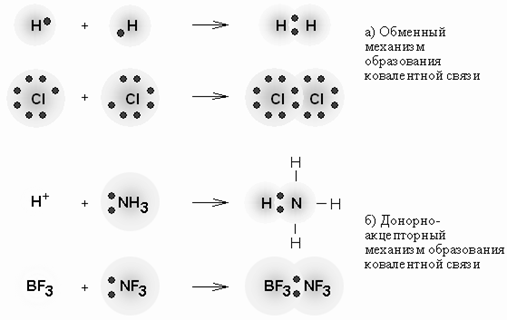
Рис. 8. Механизмы образования ковалентной связи.
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу. В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные коны, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ», обеспечивающий связь между атомами металла. Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью. Металлическая связь возникает за счет обобществления атомами валентных электронов.
 2015-02-27
2015-02-27 693
693








