Термин валидация (от англ. validate – обосновывать) в применении к уже известным методам означает устранение ошибок и оптимизацию методов, т.е. разработку правильных обоснованных методов.
Для выявления обоснованности фармакопейных требований необходимо спланировать методику, руководствуясь критериями оптимальности, и сравнить ее с фармакопейной. Рассмотрим несколько примеров.
Пример 15. Дать анализ обоснованности фармакопейных требований к определению примесей хлоридов и сульфатов в препарате «барбитал-натрий» (ГФХ, ФС 84). Текст фармакопейной методики таков:
«Хлориды. 1 г препарата растворяют в 15 мл воды, прибавляют 5 мл разведенной уксусной кислоты, взбалтывают в течение 2 минут и фильтруют. 2 мл фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,02% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,02% в препарате).»
Решение. Запишем условия правильности задачи.
Для хлоридов – V·P / А = 0,02 / 0,0002 = 100.
Для сульфатов – V*·P* / А* = 0,02 / 0,001 = 20
Очевидно, оптимальным решением является приготовление одного раствора из одной навески, одна часть которого берется для испытания на хлориды, а другая – на сульфаты. Однако, прежде чем принять такое решение, необходимо выяснить не будут ли реактивы и сам препарат, из которых готовится общий раствор, мешать проведению испытаний на данные примеси. Так как испытание на хлориды и сульфаты проводится в кислой среде барбитал-натрий, несмотря на то, что легко растворим в воде, будет мешать определению, поскольку при подкислении его раствора во время испытаний выпадет осадок барбитала, который малорастворим в воде. Поэтому барбитал необходимо предварительно осадить кислотой из приготовляемого раствора, осадок отфильтровать, а фильтрат использовать для приготовления испытуемых растворов.
Возникает вопрос: какую кислоту выбрать для обработки раствора барбитал-натрия и осаждения барбитала? Очевидно, ни серную ни соляную кислоты для этой цели использовать нельзя, поскольку тогда не удастся определить обе примеси, используя один общий приготовленный раствор. Для этой цели можно использовать азотную или уксусную кислоты, поскольку они не мешают испытаниям ни на хлориды, ни на сульфаты. Выбираем для подкисления приготовляемого раствора разведенную уксусную кислоту (хотя можно использовать и азотную кислоту).
Расчет необходимого количества разведенной уксусной кислоты необходимо делать после определения навески препарата.
Математически условие оптимального решения можно записать так:
V / А = V* / А*, тогда Р / Р* = 100 / 20 = 5
Планирование начинаем с выбора разведения для приготовления испытуемого раствора на сульфаты (Р*), поскольку для сульфатов соотношение СН/CЭ меньше, чем для хлоридов. Планируем Р* = 1, тогда разведение приготовленного общего раствора для получения испытуемого раствора на хлориды составит – Р = 5.
Планируем объем общего приготовляемого раствора:
10 мл – часть общего объёма, необходимая для определения сульфатов;
2 мл – часть общего объёма, необходимая для получения 5-кратным
разведением 10 мл испытуемого раствора для определения хлоридов;
3 мл – потери на фильтрование.
Итого: общий объем приготовляемого раствора – 15 мл.
Навеска препарата при этом составит: А = 15·1 / 20 = 15·5 / 100 = 0,75 г.
Теперь, зная навеску барбитал-натрия, рассчитываем количество уксусной кислоты, необходимое для полного осаждения барбитала, по уравнению реакции. Планируем использовать разведенную уксусную кислоту. Необходимый объем разведенной уксусной кислоты определяем с учетом ее концентрации (30%). Пренебрегая плотностью разведенной уксусной кислоты, поскольку она близка к 1 можно записать:
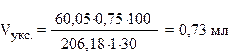
Расчетное значение составляет около 0,73 мл. Практически используемое количество реактива должно быть гарантировано больше расчетного (обычно в 2-3 раза). Использовать большие избытки нет необходимости, хотя и возможно. Планируем объем разведенной уксусной кислоты 2 мл, тогда объем воды составит – 15 – 2 = 13 мл. Проверяем растворится ли 0,75 г препарата в 13 мл воды (препарат легко растворим в воде, следовательно – растворится).
Ответ: P* = 1, Р = 5, Vвода = 13 мл, Vукс. = 2 мл, A = 0,75 г.
Соответствующая этим значениям методика:
Хлориды. 0,75 г препарата растворяют в 13 мл воды, прибавляют 2 мл разведенной уксусной кислоты, взбалтывают в течение 2 минут и фильтруют. 2 мл фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,02% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,02% в препарате).
Вывод. Как видно из сопоставления методик, фармакопейная методика правильна, но не оптимальна. В результате оптимизации расход препарата уменьшен на 25%, а уксусной кислоты больше чем вдвое.
Пример 16 Дать анализ обоснованности фармакопейных требований к определению примесей хлоридов, сульфатов и тяжелых металлов в препарате «натрия цитрат для инъекций» (ГФХ, ФС 429). Текст фармакопейной методики таков:
«Хлориды. 3 г препарата растворяют в 30 мл воды. 10 мл полученного раствора должны выдерживать испытание на хлориды (не более 0,002% в препарате).
Сульфаты. 10 мл того же раствора должны выдерживать испытание на сульфаты (не более 0,01% в препарате).
Тяжелые металлы. 5 мл того же раствора разведенные водой до 10 мл, должны выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).»
Решение. Запишем условия правильности задачи.
Для хлоридов – V·P / А = 0,002 / 0,0002 = 10.
Для сульфатов – V*·P* / А* = 0,01 / 0,001 = 10
Для тяжелых металлов – V**·P** / А** = 0,001 / 0,00005 = 20.
Планируем: Р = Р* = 1, тогда Р** = 2.
Оптимальный объем с учетом того, что вещество легко растворимо в воде и не мешает определению примесей, равен 10 + 10 + 5 = 25 мл. Отсюда навеска на анализ составит: 25·1 / 10 = 2,5 г
Ответ: Р = P* = 1, Р** = 5, V = 25 мл, A = 2,5 г. Соответствующая этим значениям методика:
Хлориды. 2,5 г препарата растворяют в 25 мл воды. 10 мл полученного раствора должны выдерживать испытание на хлориды (не более 0,002% в препарате).
Сульфаты. 10 мл того же раствора должны выдерживать испытание на сульфаты (не более 0,01% в препарате).
Тяжелые металлы. 5 мл того же раствора, разведенные водой до 10 мл, должны выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).
Вывод. Как видно из сопоставления методик, фармакопейная методика правильна, но не оптимальна. Нет никакой необходимости готовить 30 мл раствора. В результате оптимизации расход препарата уменьшен на 16,6%.
Пример 17. Дать анализ обоснованности фармакопейных требований к определению примесей хлоридов и сульфатов в препарате «норсульфазол-натрий» (ГФХ, ФС 460). Текст фармакопейной методики таков:
Хлориды. 0,5 г препарата растворяют в 20 мл воды, прибавляют 0,5 мл разведенной азотной кислоты и взбалтывают. Выпавший осадок отфильтровывают. 4 мл фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,02% в препарате).
Сульфаты. 0,5 г препарата растворяют в 20 мл воды, прибавляют 0,5 мл разведенной соляной кислоты и взбалтывают. Выпавший осадок отфильтровывают. 10 мл фильтрата должны выдерживать испытание на сульфаты (не более 0,04% в препарате).
Решение. Проверка фармакопейной методики по уравнению (6) показывает, что она позволяет верно контролировать заданные значения пределов содержания хлоридов и сульфатов в препарате:
для хлоридов – СН = СЭ·V·P / А = 0,0002·20·2,5 / 0,5 = 0,02%
для сульфатов – СН = СЭ·V·P / А = 0,001*20*1 / 0,5 = 0,04%
Хотя фармакопейная методика верна, она не оптимальна. Рассматриваемая ситуация с методологической точки зрения аналогична ситуации при определении хлоридов и сульфатов в препарате «барбитал-натрий» и может быть оптимизирована аналогично. Для этого необходимо приготовить один раствор, предварительное осаждение норсульфазола осуществить, например, азотной кислотой, которая не мешает определению ни хлоридов, ни сульфатов. В отличие от барбитала, который не растворим в избытке кислоты, норсульфазол, выпадающий в осадок при подкисление раствора норсульфазол-натрия, растворяется в избытке кислоты. Поэтому в этом случае целесообразно запланировать столько разведенной азотной кислоты, чтобы первоначально образующийся осадок растворился. Тем не менее фильтрование может оказаться необходимым, поскольку в препарате может присутствовать специфическая примесь N-ацетилпроизводного не растворимого в разведенной азотной кислоте.
С учетом этих соображений оптимальным является следующее решение.
Для хлоридов – V·P / А = 0,02 / 0,0002 = 100.
Для сульфатов – V*·P* / А* = 0,04 / 0,001 = 40
Отсюда Р* = 1, Р = 2,5;
Планируем объем общего приготовляемого раствора:
10 мл – часть общего объёма, необходимая для определения сульфатов;
4 мл – часть общего объёма, необходимая для определения хлоридов;
2 мл – потери на фильтрование.
Итого: общий объем приготовляемого раствора – 16 мл. А = 16·1 / 40 = 0,4 г.
В этот объём должен входить объём разведенной азотной кислоты необходимый для растворения первоначально образующегося осадка норсульфазола. Теоретически необходимый для осаждения норсульфазола объём разведенной азотной кислоты (С = 16%,ρ = 1,09 г/мл) равен:
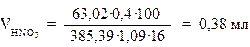
Следовательно теоретически необходимый объём разведенной азотной кислоты равен 0,76 мл. Планируем использовать 4 мл.
Ответ. Текст методики приготовления испытуемых растворов для определения хлоридов и сульфатов:
Хлориды. 0,4 г препарата растворяют в 12 мл воды, прибавляют 4 мл разведенной азотной кислоты, взбалтывают, перемешивают до растворения первоначально выпавшего осадка и при необходимости фильтруют.
4 мл фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,02% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,04% в препарате).
Вывод. Оптимальное решение позволяет уменьшить необходимое для анализа количество препарата более чем вдвое (0,4 г вместо 1 г), уменьшить число операций в ходе анализа (одно взвешивание вместо двух, одна операция растворения вместо двух и одно фильтрование вместо двух).
Пример 18 Дать анализ обоснованности фармакопейных требований к определению примесей хлоридов и сульфатов в препарате «бензонал» (ГФХ, ФС 92). Текст фармакопейной методики таков:
Хлориды. 0,1 г препарата взбалтывают с 25 мл воды в течение 2-3 мин и фильтруют, 5 мл фильтрата, разведенные водой до 10 мл, должны выдерживать испытание на хлориды (не более 0,01% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,025% в препарате).
Решение. Расчет численных значений пределов содержания хлоридов и сульфатов по уравнению (6), которые контролируются по приведенной выше фармакопейной методике, дает следующие значения:
для хлоридов – Сн = 0,0002·25·2 / 0,1 = 0,1%;
для сульфатов – Сн = 0,001·25·1 / 0,1 = 0,25%,
Рассчитанные значения пределов содержания и хлоридов и сульфатов не согласуются с нормированными значениями этих величин и превышают их на порядок.
Ответ. В методике допущена ошибка. Если правильно указан предел содержания примесей, то навеска препарата не верна и должна составлять не 0,1 г, а 1,0 г.
Пример 19. Дать анализ обоснованности нормированного ГФХ предела содержания аммиака в воде дистиллированной (ФС 73).
В ГФХ (ФС 73) приведен следующий текст методики:
Аммиак. 10 мл воды не должны содержать аммиака более чем 1 мл эталонного раствора, разведенного водой до 10 мл (не более 0,00002% в препарате).
Решение. Концентрация фармакопейного эталонного раствора аммиака равна 0,0002% (ГФХ, стр. 750). После десятикратного разведения, в соответствии с фар-макопейной методикой, его концентрация составит 0,00002%. После подстановки в уравнение (6) указанных в методике значений величин имеем:
СН = 0,00002·10·1 / 10 = 0,00002%,
что и указано в фармакопейной на воду дистиллированную.
Казалось бы, все верно, однако, в рассматриваемой методике (а также в более ранних изданиях – ГФIX и ГФVIII) допущена методологическая ошибка, а именно, эталонный раствор аммиака разводят в 10 раз, что недопустимо. Фармакопейный эталонный раствор аммиака может быть максимально разведен лишь в 6,7 раза, как это видно из таблицы и приведенного выше обсуждения границ изменения концентрации эталонных растворов, если полагать, что чувствительность реакции на аммиак, приведенная в ГФХ (стр. 750), верна.
Предпринятая нами проверка чувствительности реакции на аммиак с использованием воды, полученной дистилляцией с добавкой серной кислоты в перегонную колбу, как это описано в методе Къельдаля (ГФХ, стр.762-763), подтвердила фармакопейную величину (0,00003%).
Возникает вопрос, почему же эта ошибка не замечалась столь длительное время при практическом выполнении анализа? Ответ, по-видимому, заключается в том, что для анализа использовалась обычная дистиллированная вода, которая путем обычной дистилляции от аммиака не освобождается.
Ответ. Приведенная в ГФХ (ФС 73) норма по пределу содержания аммиака в воде дистиллированной и методика её контроля противоречит чувствительности реакции на аммиак. В 1987 году вступила в действие новая фармакопейная статья под названием «вода очищенная», в которой эта методологическая ошибка устранена. В ней предел содержания аммиака нормирован следующим образом:
Аммиак. 10 мл воды не должны содержать аммиака более чем 10 мл эталонного раствора (не более 0,0002% в препарате).
Однако на этом история с водой не закончилась. В 1997 году появилась ныне действующая фармакопейная статья - ФС 42-2619-97 «вода очищенная», в которой контроль предела содержания аммиака нормирован следующим образом:
«Аммиак. К 10 мл воды прибавляют 0,15 мл реактива Несслера, перемешивают и через 5 минут сравнивают с раствором, состоящим из смеси 1 мл эталонного раствора Б, содержащего 0,002 мг иона аммония 9 мл воды свободной от аммиака и такого же количества реактива, которое прибавлено к испытуемому раствору. Окраска, появившееся в испытуемом растворе, не должна превышать эталон (0,00002%) (в препарате).
Вывод. Поскольку чувствительность реакции на аммиак официально не пересмотрена, да и вряд ли это возможно, поскольку это константа, характеризующая реакцию, в ныне действующей ФС 42-2619-97 «вода очищенная», по-прежнему сохраняется противоречие между чувствительностью реакции на аммиак и концентрацией рабочего эталонного раствора аммиака.
В заключение следует еще раз подчеркнуть, что основным методологическим положением фармакопейного анализа чистоты лекарственных веществ, отличающим его от технического анализа чистоты химических продуктов и реактивов, является то, что для контроля различных численных значений пределов содержания примесей в различных лекарственных препаратах используют одни и те же рабочие эталонные растворы этих примесей с определенной, регламентированной ГФХ и ГФХI, концентрацией.
 2015-02-27
2015-02-27 1684
1684








