Термодинамические данные позволяют связать 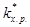 со стандартной свободной энергией образования переходного комплекса D G ¹, называемой также свободной энергией активации: DG’¹ = -RT ln
со стандартной свободной энергией образования переходного комплекса D G ¹, называемой также свободной энергией активации: DG’¹ = -RT ln 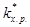 , (8.38)
, (8.38)
откуда 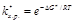 .(8.39) Тогда для константы скорости химической реакции можно записать
.(8.39) Тогда для константы скорости химической реакции можно записать 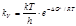 . (8.40)
. (8.40)
Из этого уравнения видно, что скорость реакции определяется свободной энергией активации D G ¹, а не Еа, как это следует из теории активных соударений Аррениуса.
Поскольку D G ¹ = D Н ¹ - Т D S ¹, то 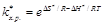 (8.41)
(8.41)
или, по теории переходного состояния, kv равна: 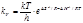 (8.42)
(8.42)
или 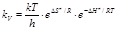 ,(8.43) т.е. мы получили термодинамическую форму основного уравнения теории переходного состояния.
,(8.43) т.е. мы получили термодинамическую форму основного уравнения теории переходного состояния.
 2015-02-04
2015-02-04 808
808








