Титриметрический анализ объединяет группу методов количественного химического анализа, основанных на измерении количества реагента, необходимого для взаимодействия с определяемым компонентом.
Количественные соотношения между реагирующими веществами выражаются законом эквивалентов:
Химические элементы и их соединения взаимодействуют в химических реакциях друг с другом в строго определенных массовых количествах, соответствующих их химическим эквивалентам.
Эквивалент (Э) – реальная или условная частица вещества Х, которая эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону окислительно-восстановительной реакции (должна быть указана конкретная химическая реакция).
Э = fЭ (Х) Х
Фактор эквивалентности (fЭ) – число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
fЭ (Х) = 1/z; где: z – число эквивалентности
при fЭ = 1 Þ Э = РЧ (реальная частица); при fЭ < 1 Þ Э = УЧ (условная частица).
Масса 1 моль эквивалента называется молярной массой эквивалента (МЭ).
МЭ = fЭ ´ М
Важным следствием закона эквивалентов является основное уравнение титриметрии:
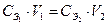
Произведение молярной концентрации эквивалента (СЭ) на объем раствора есть величина постоянная для обоих реагирующих веществ.
Расчеты в титриметрии основаны на принципе эквивалентности.
При выполнении расчетов следует учитывать некоторые метрологические правила: концентрация и масса вычисляются до четвертой значащей цифры после запятой, титр – до четвертой значащей цифры после нулей, объем и массовая доля в % – до сотых долей. Значащими являются все цифры, отличные от нуля. Сам нуль может быть значащим, если расположен между значащими цифрами или после них. Лишние цифры рекомендуется округлять.
 2015-02-04
2015-02-04 429
429








