Как уже отмечалось, скорость химической реакции варьируется в широких пределах. Возникает необходимость изменять скорость химических реакций: в одних случаях их требуется ускорить, в других случаях – замедлить. Так, смесь кислорода с водородом может годами оставаться без изменения – вода не получится. Стоит в эту смесь поместить немного платиновой черни и скорость реакции увеличивается настолько, что происходит мгновенное взаимодействие кислорода с водородом и образуется вода. Коррозия металлов, которая возникает в результате взаимодействия металла со средой, приводит к ежегодной потере двух процентов ценного материала. Поэтому разрабатываются способы снижения скорости процесса коррозии. Увеличение или снижение скорости химической реакции достигается при помощи катализаторов.
Катализ – это изменение скорости или возбуждение химических реакций веществами, которые участвуют в реакции, но не входят в состав продуктов реакции. Вещество, изменяющее скорость реакции и остающееся после реакции в неизменном состоянии и количестве, называется катализатором, а реакции под действием катализаторов – каталитическими.
Катализаторами могут являться самые разнообразные вещества.6 кислоты, соли, основания, оксиды, металлы, органические соединения, газообразные вещества.
Катализаторы способны многократно участвовать в химических реакциях в незначительном количестве и вызывать превращения значительных масс вещества. Так, одна массовая часть катализатора в производстве серной кислоты вызывает превращение 10000 массовых частей реагирующих веществ., а впроизводстве азотной кислоты до 1000000.
Катализаторы изменяют скорость химической реакции в двух диаметрально противоположных направлениях: ускоряют их в случае положительного катализа и замедляют, когда катализ отрицательный. Отрицательный катализ называют ингибированием, а вещества, его вызывающие – ингибиторами. Именно ингибиторы коррозии применяют для предотвращения или замедления процесса ржавления.
Катализатор не влияет на химическое равновесие и не изменяет значение константы равновесия, а лишь определяет время установления равновесного состояния. Катализатор не влияет на состояние исходных веществ и продуктов реакции и не увеличивает выход продуктов реакции.
Когда катализатор и исходные вещества находятся в одной фазе, то такой катализ называют гомогенным, а если в разных - гетерогенным. Наиболее распространен гетерогенный катализ, когда катализатор – твердое вещество, а реагирующие вещества находятся в жидкой или газообразной фазе. В этом случае процесс протекает на границе раздела фаз.
Возможны автокаталитические реакции. Эти реакции сами себя делают каталитическими за счет продуктов реакции, которые и выполняют функцию катализаторов. Например, гидролиз сложных эфиров:
R – C – O – R′ + H2O → R – C – OН + R′ - OH
║ ║
O O
Образующаяся в результате реакции карбоновая кислота диссоциирует в водном растворе, появляются ионы водорода. Они и ускоряют процесс гидролиза.
Кроме того, катализатор должен иметь достаточную механическую прочность, твердость, способность к регенерации. Но основное его достоинство каталитическая активность.
Активность и избирательность катализатора можно увеличить в сотни раз добавлением промоторов. Эти вещества обычно проявляют свое действие в небольших количествах – до нескольких процентов от массы катализатора. Так железный катализатор, применяемый для синтезе аммиака, содержит менее 1% промотора оксидов алюминия и калия.
Но есть вещества, которые снижают каталитическую активность катализатора или полностью исключают его каталитическое действие. Это каталитические яды, они отравляют катализатор. К каталитическим ядам относят сурьму, фосфор, свинец, мышьяк, ртуть, медь и др.
Каждый катализатор специфичен, т.е проявляет свою каталитическую активность только в отношение определенных реакций или даже одной. Специфичность катализатора проявляется по-разному: может распространяться на несколько классов химических реакции. Так кислоты катализаторы для многих классов химических соединений. В то же время ферменты, как биологические катализаторы, ускоряют лишь определенный биологический процесс.
Специфичность катализатора проявляется еще и в его селективности. Например при взаимодействии углекислого газа с водородом в присутствии никеля образуется метан, а в присутствии меди метиловый спирт:
СО + Н2 → СН4 + Н2О
СО + Н2 → СН3ОН
Почему катализатор ускоряет химические реакции? Для того чтобы реакция произошла необходимо преодолеть энергетический барьер, который определяется энергией активации. При участии катализатора энергетический барьер уменьшается, т.к. снижается энергия активации, что приводит к повышению доли активных частиц.
Каков же механизм воздействия катализатора? Катализатор с одним из реагирующих веществ образует непрочное промежуточное соединение, которое легко взаимодействует со вторым компонентом реакции.
1) А +К = АК 2) АК + В = АВ + К
Большое влияние на скорость каталитических реакций оказывает степень дисперсности катализатора, температура (с повышением температуры увеличивается), давление, растворитель.
В живых организмах также протекают многочисленные химические процессы. Основная их масса протекает с участием биологических катализаторов – ферментов. Ферментативный катализ существенно отличается от химического катализа.
Биологические катализаторы в миллионы раз активнее химических катализаторов. Так, например, 1 г кристаллического пепсина расщепляет 50 кг коагулированного яичного белка, а 1 г кристаллического ренина свертывает 72 т молока.
Ферменты обладают высокой специфичностью, каждый из них действует лишь на определенную реакцию или группу реакций, протекающих в организме. Предполагается, что в организме человека функционирует одновременно около 1000 ферментов.
В процессе протекания каталитической реакции фермент постепенно разрушается и утрачивает свою активность. Это инактивация.
По сравнению с катализаторами, ферменты имеют значительно более сложное строение.
Влияние внешних условий. Они очень чувствительны к изменению внешних условий, например, работают в узком диапазоне температур (40-60°С), при повышении температуры его активность быстро падает, при 70-80°С происходит их необратимое разрушение. Они проявляют свою активность при определенных значениях рН (пепсин 1,5-2, уреаза 6,7, фруктофуноксидаза 4,5-6,6)
Лекция 14 «Равновесное состояние. Константа химического равновесия».
Состояние системы может быть равновесным или неравновесным. Если термодинамические параметры с течением времени не изменяются без каких-либо внешних воздействий на систему, такое состояние называют равновесным. Состояние системы будет неравновесным, если ее параметры изменяются при отсутствии воздействия.
Любая изолированная система с течением времени переходит в термодинамически равновесное состояние и самопроизвольно выйти из этого состояния не может, параметры равновесной системы могут иметь только строго определенные значения и, следовательно, к таким системам применимы любые уравнения состояния.
До сих пор мы рассматривали реакции, идущие в одном направлению Но наряду с этими реакциями, в природе весьма распространены процессы идущие в двух взаимопротивоположных направления. Такие реакции называют обратимыми.
Обратимыми реакциями называют такие реакции, при которых продукты той или иной химической реакции, реагируя друг с другом, дают исходные вещества.
В любой обратимой реакции можно различить два процесса, идущих во взаимопротивоположном направлении:
аА +вВ ↔ сС + дД прямая и обратная реакции
Скорость обратимых реакций подчиняется тем же законам, что и необратимых.
νпрям =k[A]а[В]в
νобрат = k[С]с[Д]д
В начале реакции максимальной скоростью будет обладать прямая реакция, в то время как скорость обратного процесса будет равна нулю. Со временем концентрации исходных веществ будут уменьшаться, а значит, скорость прямой реакции будет уменьшаться, а концентрация продуктов реакции расти, а значит со временем будет расти и скорость обратного процесса.
Наступит момент когда скорость прямого процесса станет равной скорости обратного процесса, т.е они будут протекать с одинаковой скоростью.
В дальнейшем в каждый данный отрезок времени образуется столько же продуктов прямой реакции, сколько образуется продуктов обратной. Наступает состояние химического равновесия, при котором реакция не останавливается, но идет с одинаковой скоростью в обоих направлениях.
νпрям = νобрат k1[A][В]= k2[С][Д]
В данном случае будет справедлива пропорция:
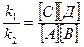 k=
k= 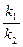
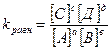 , где k – константа равновесия
, где k – константа равновесия
Это уравнение равновесия обратимой реакции.
Химическое равновесие наступает тогда, когда произведение концентрации продуктов реакции в степени стехиометрических коэффициентов деленное на произведение концентрации исходных веществ в степени стехиометрических коэффициентов постоянное.
По значению констант равновесия можно судить о направлении и глубине протекания процесса при исходном соотношении концентраций реагирующих веществ, о максимально возможном выходе продукта реакции при тех или иных условиях. При k>1 в равновесной смеси преобладают продукты реакции, при k <1 – исходные реагенты.
Константа химического равновесия зависит от природы реагентов и от температуры.
 2015-02-04
2015-02-04 1556
1556
