Пример 6.3. Рассчитать pH 25% раствора NH4OH, считая это вещество слабым электролитом с константой диссоциации 1,8×10–5. Плотность раствора – 0,9 г/мл.
По определению процентной концентрации
в 100 г раствора содержится 25 г NH4OH.
n(NH4OH) = m(NH4OH) / M(NH4OH) = 25 г: 35 г/моль = 0,714 моль;
Vраствора = mраствора / ρраствора = 100 г: 0,9 г/мл = 111 мл = 0,111 л;
С(NH4OH) = n(NH4OH) / Vраствора = 0,714 моль: 0,111 л = 6,43 моль/л = C0.
C0 – это общая концентрация электролита в растворе
NH4OH – слабый электролит, обратимо диссоциирующий в водном растворе: NH4OH ⇆ NH4+ + OH–. Поскольку слабый электролит диссоциирует неполностью, сделаем предположение, что продиссоциировало x моль/л NH4OH, тогда равновесная концентрация ионов аммония и гидроксид-ионов также будут равняться x моль/л: C(NH4+) = C(OH–) = x моль/л. Равновесная концентрация непродиссоциировавшего основания равна С(NH4OH) = C0 – x =
= (6,43 – x) моль/л.
Подставляем выраженные через x равновесные концентрации всех частиц в уравнение константы диссоциации:
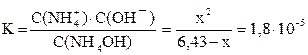 .
.
Обычно в задачах по общей и неорганической химии иксом в знаменателе пренебрегают в том случае, если 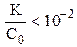 . В данном случае это условие выполняяется, следовательно электролит диссоциирует незначительно (x ® 0), и иксом в знаменателе как слагаемым можно пренебречь:
. В данном случае это условие выполняяется, следовательно электролит диссоциирует незначительно (x ® 0), и иксом в знаменателе как слагаемым можно пренебречь:
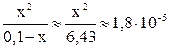 .
.
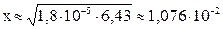 моль/л
моль/л
С(OH–) = x = 1,076∙10-2 моль/л; pOH = –lg C(OH–) = –lg 1,076∙10–2 = 1,97.
pH = 14 – pOH = 14 – 1,97 = 12,03.
 2015-02-04
2015-02-04 9962
9962








