H3PO4 – слабая трёхосновная кислота, обратимо диссоциирующая в водном растворе (преимущественно по первой стадии): H3PO4 ⇆ H+ + H2PO4–.
C(H+) = 10–pH = 10–1,7 = 1,995·10–2 (моль/л)
Если бы продиссоциировало x моль/л фосфорной кислоты, тогда равновесная концентрация ионов водорода и дигидрофосфат-ионов была бы равна x моль/л: C(H2PO4–) = C(H+) = x моль/л. Концентрация непродиссоциировавшей кислоты в этом случае будет равна: С(H3PO4) = С0 – x моль/л.
В данном примере величина х известна:
x = C(H+) = C(H2PO4–) = 1,995·10–2 моль/л
|
|
|
|
|
|
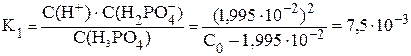
С0 = 0,073 (моль/л).
По определению молярной концентрации
в 1 л раствора содержится 0,073 моль H3PO4.
mраствора = Vраствора · ρраствора = 1000 мл · 1 г/мл = 1000 г.
m(H3PO4) = n(H3PO4) · M(H3PO4) = 0,073 моль · 98 г/моль = 7,157 г.
ω(H3PO4) = m(H3PO4) / mраствора = 7,157 г / 1000 г = 0,007157 (0,716 %)
 2015-02-04
2015-02-04 6549
6549
