Приготовление растворов заданной массовой концентрации растворенного вещества. Растворы готовят в специальной мерной посуде: мерных колбах, мерных цилиндрах, градуированных стаканах (рис. 1, 2).
С помощью технических или аналитических весов (в зависимости от заданной точности приготовления) отвешивают расчетное количество твердого вещества, переносят в мерную посуду, растворяют в небольшом количестве воды и доливают дистиллированную воду до отметки заданного объема (доводят до метки). Растворы можно готовить также разбавлением более концентрированных растворов.
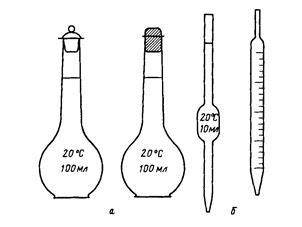
Рис. 1. Мерные колбы (а), пипетки (б)
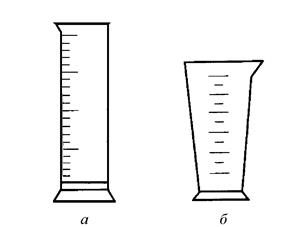
Рис. 2. Мерный цилиндр (а), мерный стакан (мензурка) (б)
Пример 1. Приготовить 0,5 дм3 15 г/дм3 раствора гидроксида натрия. Рассчитаем массу вещества по уравнению (1)
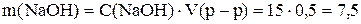 г
г
Навеску 7,5 г растворяем в мерной колбе на 500 см3.
Приготовление растворов с заданной массовой долей. Растворы готовят в химически стойкой посуде без градуировки объема. С помощью технических или аналитических весов отвешивают расчетное количество твердого вещества, переносят в мерную посуду и растворяют в расчетном количестве воды. Такие растворы можно готовить разбавлением концентрированных или смешением концентрированных и более разбавленных (или воды) растворов.
Пример 2. Приготовить 500 г 5% раствора гидроксида натрия. По уравнению (2) рассчитаем массу NaOH
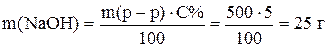
Масса воды равна
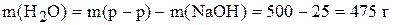 .
.
Таким образом, для приготовления раствора надо растворить 25 г твердого NaOH в 475 г воды.
Пример 3. Приготовить 3 кг 30% раствора серной кислоты из 95% и 10% раствора. Для приготовления необходимо рассчитать массы обоих растворов. Ранее для этого рекомендовали использовать правило «креста», в настоящее время с развитием вычислительной техники проще решить систему двух уравнений или воспользоваться готовой формулой. Введем обозначения x – необходимая масса 95% кислоты; y - необходимая масса 10% кислоты; m – масса конечного раствора, С%(1) – массовая доля 95% кислоты; С%(2) – массовая доля 10% кислоты; С%(к) – массовая доля приготовляемой кислоты.
Сумма масс кислоты в исходных растворах равна массе кислоты в конечном растворе, сумма масс растворов исходных кислот равна массе приготовляемой кислоты. Тогда получим систему из двух уравнений
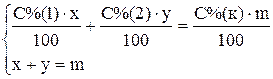 .
.
Откуда
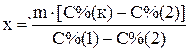 ;
; 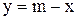 .
.
Подставив численные значения, получим:
х = 706 г; y = 2294 г.
Часто удобнее пользоваться не массой, а объемом растворов. В этом случае по справочнику определяют плотность исходных растворов и рассчитывают их объемы:
Для 95% кислоты 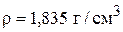 ;
; 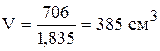
Для 10% кислоты 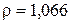 ;
; 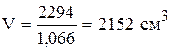 .
.
Таким образом, для приготовления 3 кг 30% раствора серной кислоты необходимо отмерить 385 см3 95% кислоты и прибавить 2152 см3 10% кислоты.
Если в качестве второго раствора берут чистую воду, то принимают С%(2) = 0.
Приготовление растворов с заданной молярной концентрацией или молярной концентрацией эквивалента. Растворы готовят в специальной мерной посуде: мерных колбах, мерных цилиндрах (рис. 1, 2). С помощью технических или аналитических весов отвешивают расчетное количество твердого вещества, переносят в мерную посуду, растворяют в небольшом количестве воды и доливают дистиллированную воду до отметки заданного объема (доводят до метки). Такие растворы можно готовить также разбавлением более концентрированных растворов.
Пример 4. Приготовить 250 см3 раствора NaOH с концентрацией 0,5 н из 10% раствора, r = 1,11 г/см3.
Массу NaOH, необходимую для приготовления раствора рассчитаем из уравнения (3)
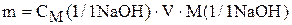
Такая же масса NaOH должна содержаться в пробе 10% раствора
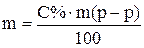
Приравняв правые части уравнений получим
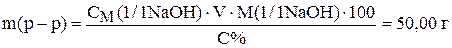 .
.
Рассчитаем объем раствора
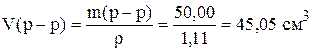 .
.
Таким образом, для приготовления раствора необходимо в мерную колбу на 250 см3 отмерить 45,05 см3 раствора NaOH с концентрацией 10%, довести до метки дистиллированной водой, и перемешать.
 2015-05-26
2015-05-26 26062
26062
