Различают молярную теплопроводность C (количество теплоты, которое необходимо сообщить 1 молю вещества, чтобы повысить его температуру на 1 К) и удельную теплоемкость (рассчитывается на единичную массу). Между молярной C и удельной C0 теплоемкостью существует связь
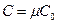 , , |
где m – молярная масса.
Для газа существенно, каким образом происходит его нагревание, поэтому различают:
теплоемкость при изотермическом процессе (T=const)
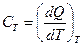 ; ; |
теплоемкость при изохорном процессе (V=const)
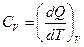 ; ; |
теплоемкость при изобарном процессе (P=const)
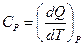 . . |
При изотермическом процессе температура не меняется, поэтому dT=0, СT=¥.
При изохорном процессе dQ=dU, так как работа в таком процессе не совершается, поэтому
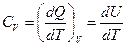 , , | (9.11) |
и, следовательно,
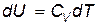 . . | (9.12) |
Теплоемкость при постоянном давлении
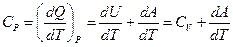 . . | (9.13) |
Представим с помощью уравнения Менделеева-Клапейрона элементарную работу, совершаемую 1 молем идеального газа при изобарном процессе в виде
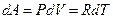 . . | (9.14) |
Подставив (9.14) в выражение (9.13), получим формулу Майера:
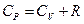 . . | (9.15) |
т.е. CP > CV на величину универсальной газовой постоянной.
Выразим теперь молярные теплоемкости CV и CP через число степеней свободы. С учетом (9.10) из (9.11) следует
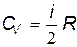 . . | (9.16) |
Зная CV, из формулы Майера находим
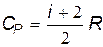 . . | (9.17) |
Отношение
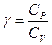 | (9.18) |
называется коэффициентом Пуассона. Этот коэффициент с помощью (9.16) и (9.17) можно выразить через число степеней свободы
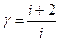 . . | (9.19) |
Значения коэффициента Пуассона для различных газов приведены в табл. 9.1.
Таблица 9.1
| Газ | Cp | 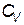 | Число степеней свободы | g |
| Одноатомный | 5/2R | 3/2R | 3 | 1,67 |
| Двухатомный | 7/2R | 5/2R | 5 | 1,40 |
| Многоатомный | 8/2R | 6/2R | 6 | 1,33 |
 2015-02-04
2015-02-04 1973
1973








