β–лактамные антибиотики
В 1877 г. Пастер обратил внимание на токсическое действие плесеней, 1928г. – работы Флемминга по изучению пенициллинов, в 1941 г. был выделен бензилпенициллин (пенициллин- G), a в 1945 г. была установлена его структура:
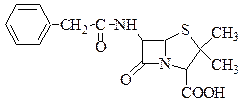
Бензилпенициллин легко гидролизуется, гидролизом в различных средах можно установить составные части этого соединения:
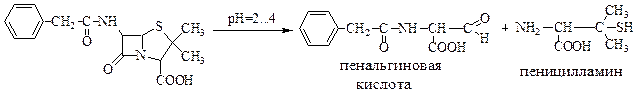
Наличие тиазольного цикла позволил установить щелочной гидролиз:
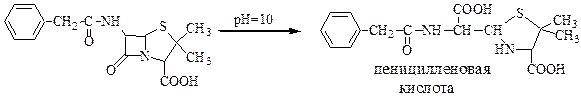
Далее следовало установление наличия β–лактамного цикла:
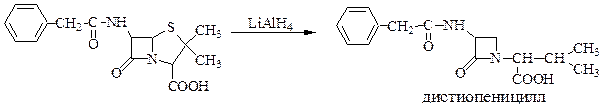
Схема 58
В 1957 г. пенициллин-G был синтезирован в лаборатории, однако синтез является чрезвычайно громоздким и не используется на производстве.
По своей структуре бензилпенициллин напоминает полуоткрытую книгу, т.к. тиазольный цикл немного приподнят над плоскостью.
Группа СООН является очень важной в структуре пенициллинов, её нельзя закрывать или убирать; с другой стороны, данная группа легко ионизируется, а следовательно снижается активность пенициллинов против грамотрицательных микроорганизмов.
Метильные группы не влияют на активность соединения, их можно заменить, например, на этильные и т.п.
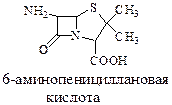 Сера не влияет на активность и свойства соединений, её можно заменить, например, на кислород.
Сера не влияет на активность и свойства соединений, её можно заменить, например, на кислород.
Очень важно наличие напряженной конденсированной системы и аминогруппы, однако 6-аминопеницил-лановая кислота не обладает антибактериальными свойствами, в молекуле крайне важно присутствие ацильного заместителя (причем его можно варьировать)
Бензилпенициллин невозможно использовать в растворах, легко разрушается и легко переходит в пенициллоиновую кислоту:
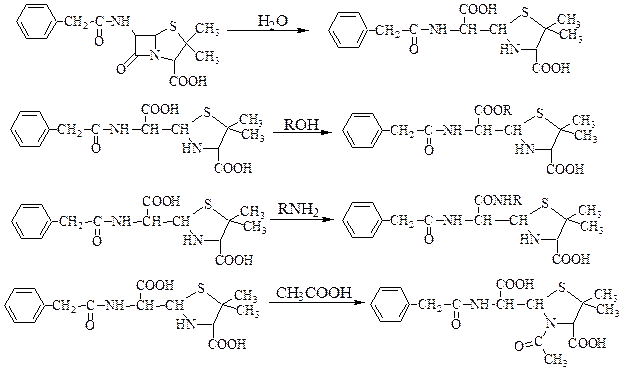 Схема 59
Схема 59
Пенициллины еще легче подвергается изомеризации в кислой среде.
Существует необходимость менять структуру пенициллинов (бактерии производят β-лактамазу, которая разрушает лекарство).
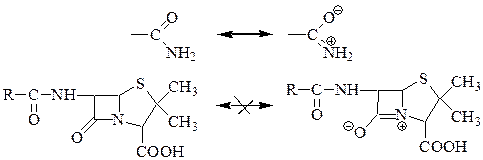
Схема 60.
Повышенная напряженность бициклической системы приводит к очень сильному искривлению и торсионному напряжению, поэтому в условиях кислотного гидролиза происходит очень быстрое расщепление 4-членного цикла.
Карбонильная группа в β-лактамном цикле более чувствительна к атакам нуклеофилов, чем карбонильная группа обычного амида, что обусловлено своеобразным поведением амидного азота лактамного цикла.
β 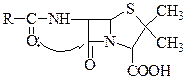 -лактамный азот не способен к перемещению свободной электронной пары в сторону карбонильной группы, т.к. при этом бициклическая система имела бы стерически сверхнапряженную форму, невозможную для реальных молекул. В результате свободная пара электронов локализуется на атоме азота, и карбонильная группа становится более электрофильной, чем можно было бы ожидать для нормального третичного амида. Нормальный третичный амид менее чувствителен к действию нуклеофилов, т.к. возможная резонансная структура снижает электрофильный характер карбонильного углерода.
-лактамный азот не способен к перемещению свободной электронной пары в сторону карбонильной группы, т.к. при этом бициклическая система имела бы стерически сверхнапряженную форму, невозможную для реальных молекул. В результате свободная пара электронов локализуется на атоме азота, и карбонильная группа становится более электрофильной, чем можно было бы ожидать для нормального третичного амида. Нормальный третичный амид менее чувствителен к действию нуклеофилов, т.к. возможная резонансная структура снижает электрофильный характер карбонильного углерода.
Все это создает условия для легкой атаки ацильного заместителя на карбонильный углерод амидной группы, что приводит к изомеризации пенициллинового цикла. Продукты изомеризации не обладают антибактериальными свойствами.
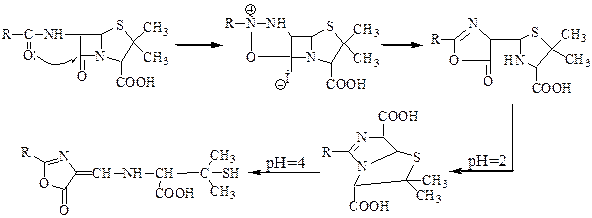
Чтобы сделать изомеризацию невозможной необходимо ввести электроноакцепторные группы:
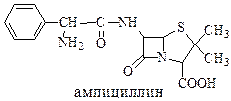
Схема 61
Пенициллин подавлял развитие грамположительных бактерий, а ампициллин активен и против грамотрицательных бактерий.
Кроме того, β-лактамный цикл можно сделать устойчивей, если ацильный заместитель является очень объемным:
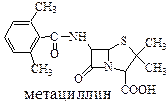 метациллин устойчивей пенициллина-G, однако, является в 15 раз менее активным препаратом.
метациллин устойчивей пенициллина-G, однако, является в 15 раз менее активным препаратом.
Объемный заместитель в ацильной части молекулы защищает β-лактамный цикл от воздействия β-пенициллиназы – фермента, продуцируемого бактериями. Этот фермент разрушает β-лактамный цикл.
Практически все антибиотики пенициллинового ряда являются полусинтетическими. Синтез антибиотиков пенициллинового ряда в промышленности, как правило, начинают с процесса ферментации, который состоит из двух основных этапов: самой ферментации (рост плесени) и процесса выделения основного действующего начала. Процесс очень сильно зависит от влияния условий окружающей среды, проводится в специальных ферментаторах, изготовленных из нержавеющей стали, объемом до 50 тыс л., при тщательном перемешивании, температуре 23-24°С, рН=6÷6,5 и постоянной аэрации. Для роста плесени создают питательную среду, состоящую из кукурузного настоя, лактозы, NaNO3, CaCO3, ZnSO4, MgSO4, KH2PO4. Процесс длится около 70 часов, после окончания роста плесени ее отделяют от культуральной жидкости на спецфильтрах и экстрагируют амилацетатом или хлороформом. Получают около 30-40% пенициллина-G.
Из пенициллина-G получают 6-аминопенициллановую кислоту (6-АПК) с помощью энзиматического процесса:
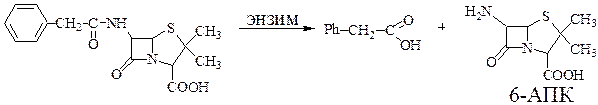
Схема 62
6-АПК сама по себе не обладает антибиотическими свойствами, но является исходным материалом для синтеза антибиотиков.
В качестве ацилирующих веществ используют азиды, хлорангидриды и ангидриды кислот. Широко применяются синтезы с применением защитных групп.
 2015-02-04
2015-02-04 562
562







