Рассмотрим равенство Клаузиуса (138). Ему можно дать следующую словесную формулировку: приведенное количество тепла, полученное системой при любом обратимом круговом процессе, равно нулю. Это означает, что приведенное количество тепла, полученное системой при обратимом не круговом процессе, не зависит от пути перехода от одного состояния к другому, а определяется лишь начальным и конечным состояниями.
Это означает, что можно определить некоторую величину, которая является функцией состояния и изменение которой при некотором обратимом процессе равна сумме приведенных теплот. Обозначим эту величину буквой S. Пусть SA – значение этой величины в состоянии A, SB – значение этой величины в состоянии B. Тогда:
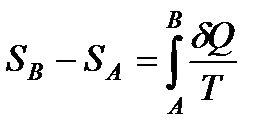 . (141)
. (141)
Равенство (141) позволяет определить не абсолютное значение функции, соответствующее данному состоянию, а лишь ее изменение при переходе от одного состояния к другому. Но, как всегда в таких случаях делается, можно выбрать некоторое состояние, которому приписывается значение S, равное нулю, и сравнивать с ним все прочие состояния. Поэтому в дальнейшем будем считать, что именно функция S равна интегралу (139):
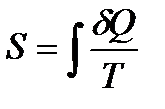 . (142)
. (142)
Определенная таким образом величина S называется энтропией. На практике всегда требуется знать не саму величину S, а только ее изменение при изменении состояния системы. Поэтому безразлично, какому именно состоянию приписать нулевую энтропию. Принято, что энтропия равна нулю при абсолютном нуле температуры.
Значит, для нахождения энтропии системы в данном состоянии надо перевести систему (это можно сделать мысленно) из этого состояния в нулевое состояние каким-либо обратимым путем (безразлично, каким именно) и найти значение 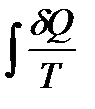 вдоль этого пути. Разумеется, сама энтропия системы совершенно не зависит от того, будет ли в действительности совершен этот обратимый процесс или нет.
вдоль этого пути. Разумеется, сама энтропия системы совершенно не зависит от того, будет ли в действительности совершен этот обратимый процесс или нет.
То же касается изменения энтропии. Чтобы определить разность значений энтропии системы в двух ее состояниях (равновесных) А и В, нужно перевести систему каким-нибудьобратимым процессом из состояния А в состояние В и вычислить изменение энтропии согласно формуле (141).
Изменение энтропии системы, которой сообщено бесконечно малое количество тепла δQ, равно
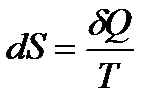 . (143)
. (143)
Величина δQ не является дифференциалом какой бы то ни было функции. Однако согласно формуле (143) если δQ есть элементарное количество тепла, квазистатически полученное системой, то после деления на Т оно переходит в полный дифференциал функции состояния – энтропии. Величина, обратная температуре, здесь играет роль интегрирующего множителя.
Таким образом, энтропию можно определить как функцию, полным дифференциалом которой является приведенная теплота при элементарном процессе.
Энтропия (S) — скалярная физическая величина, являющаяся функцией состояния системы, элементарное изменение которой при обратимом переходе системы из одного состояния в другое определяется соотношением (143).
Используя понятие энтропии, первое начало термодинамики δ Q = dU + δA можно переписать в виде:
TdS = dU + δA (144)
Это уравнение носит название термодинамического тождества. Его часто называют вторым началом термодинамики для обратимых процессов.
Собственно, второе начало термодинамики для обратимых процессов заключается в том, что система может быть охарактеризована функцией состояния — энтропией, определяемой уравнениями (143) или (144).
 2015-02-15
2015-02-15 9443
9443
