Важную роль в регуляции кроветворения играет строма костного мозга. К ней относят макрофаги, структуры эндоста — соединительно-тканной оболочки, выстилающей костномозговую полость, костномозговые синусоиды, жировые клетки, соединительную ткань и нервные окончания. Эти структуры формируют "гемопоэтическое индуцирующее микроокружение" (ГИМ), необходимое для пролиферации, дифференциации и фиксации СКК в костном мозге, размножения и созревания миелоидных клеток. Так, механическое повреждение структур стромы костномозговых синусоидов или эндоста в эксперименте тормозит регенерацию костного мозга. С эндостом, покрывающим поверхность костных трабекул, взаимодействуют делящиеся КОЕ. Более же зрелые клетки располагаются у костномозговых синусоидов. Элементы стромы формируют ГИМ, продуцируя ростковые факторы, экстрацеллюлярный матрикс, содержащий фиб-ронектин, ламинин и коллаген, глюкозаминогликаны.
СКК, КОЕ- ГММЭ и малодифференцированные бипотенциальные клетки выходят из костного мозга в кровь и циркулируют в ней. Это обеспечивает постоянный обмен клетками между анатомически разделенными участками кроветворной ткани. Однако, пролифери-ровать и дифференцироваться эти клетки способны лишь в ткани костного мозга, и необходимые для этого условия создает ГИМ. Так, адгезивный гликопротеин — фибронектин выполняет "якорную", фиксирующую функцию в отношении КОЕ-ГММЭ в эритро-идных КОЕ, и одновременно увеличивает их пролиферацию. Особые же микроворсинки ретикулярных и эндотелиальных клеток стромы фиксируют СКК и КОЕ-ГМ.
Строма костного мозга продуцирует особый фактор — модулятор, гемопоэтин-I (Г-I), который не вызывает пролиферации КОЕ, но резко усиливает пролиферативный эффект КСФ на эти клетки.
Активация эритропоэза сочетается с увеличением в нем концентрации нейтральных глюкозаминогликанов (ГАГ), а гранулоцитопоэ-за — кислых ГАГ-ов (гепарансульфата, дерматан сульфата, гиалуро-новой кислоты и др.). Эффект ГАГ реализуется через увеличение проницаемости мембран гемопоэтических клеток для кальция и активацию в них системы циклических нуклеотидов с увеличением концентрации цАМФ. Таким образом, ГАГ способствует формированию вторичных посредников, обеспечивающих быстрое распространение сигнала от рецептора гемопоэтической клетки к ее геному в ходе действия КСФ на КОЕ.
Регуляция выхода клетки из костного мозга. Сосудистая сеть костного мозга начинается от артерии, проникающей через костный канал. От центральных ее ответвлений отходят синусоиды, потом артериолы, направляющиеся к периферии кости и распадающиеся на
232
капилляры (рис.6.8.). Синусоиды представлены многочисленными разветвлениями и анастомозами, впадающими далее в прямые, а затем в центральные синусоиды, из которых кровь поступает в вены, выхо-дяшие из кости. Каждая связка извитых синусоидов, впадающая в тот же сегмент прямых синусоидов, образует с последним "синусоидальное дерево", являющееся элементарной морфо-функциональной сосудистой единицей костного мозги. Стенка синусоидов состоит из эндотелиаль-ных клеток и лежащих на них со стороны гемопоэтической ткани широких мононуклеарных адвентициальных клеток. Гемопоэтическая ткань располагается между синусоидами, созревающие эритроидные и гранулоцитарные клетки, мегакариоциты и макрофаги прилегают к наружной поверхности сосудистых синусов.
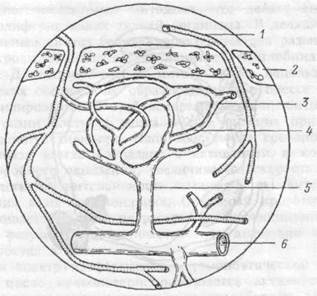
Рис.6.8. Микроциркуляция в ткани костного мозга.
"Синусоидальное дерево" образовано извитыми анастомозирующи-ми синусами, затем прямым синусом. 1 — афферентная артерия, 2 — костная ткань, 3 — извитой синус, 4 — синусоидальное дерево, 5 — прямой синус, 6 — центральный синус.
Высвобождение клеток из костного мозга в кровь связано с их проходом через отверстия между эндотелиальными клетками костномозговых синусоидов. Диаметр этих отверстий 2,3 мкм, т.е. много меньше проходящих через них в кровь клеток. Поэтому мигрирующие клетки должны обладать достаточной деформируемостью, чтобы преодолеть барьер и выйти в кровь. Плохо деформирующиеся, ригидные ядра эритробластов, миелобластов, промиелоцитов не позволяют им мигрировать через отверстия в синусоиде. Напротив, хорошо деформирующиеся ядра зрелых гранулоцитов, моноцитов и лимфоцитов дают им возможность пересекать эндотелий.
233
Важным условием миграции клеток в кровь является способность ретикулоцитов и клеток белой крови к движению. Они пересекают узкие отверстия синусов, выпуская в них сначала пседоподии. В костно- мозговых синусоидах края эндотелиальных клеток тесно прилегают друг к другу и не позволяют клеткам проходить через отверстия между ними (рис.6.9). Однако, миграция клеток через них облегчается ритмичными расслаблениями синусоидов, которые уменьшают перекрытие этими клетками пор. Поверхность эндотелиальных клеток частично покрыта адвентициальными клетками, которые легко скользят по ней, благодаря сократительному аппарату, имеющемуся у адвентициальных клеток. Сокращаясь, адвентициаль-ные клетки уменьшают покрываемую ими поверхность костно-мозговых синусоидов и увеличивают возможность миграции клеток.
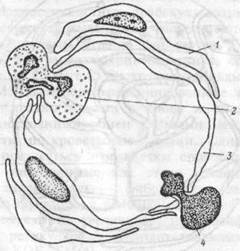
Рис.6.9. Поперечный срез костномозгового синуса.
Сегментоядерный нейтрофил и ретикулоцит пересекают стенку синуса. I — адвентициальная клетка, 2 - нейтрофил, 3 — эндотелиальная клетка, 4 — ретикулоцит.
Выход клеток в просвет синусоида возрастает под влиянием молекулярных регуляторов гемопоэза. Эритропоэтин стимулирует быстрый выход ретикулоцитов, КСФ и бактериальный эндотоксин — нейтро-филов. Эти факторы облегчают формирование отверстии в эндотелии, уменьшая внешнюю поверхность эндотелия костно-мозгового синуса, покрытого адвентициалъными клетками. Например, инъекция животному эритропоэтина резко уменьшает этот адвентициальный покров и ретикулоциты легко пересекают гемато-модулярный барьер.
В норме небольшая часть клеток погибает в костном мозге и подвергается фагоцитозу, не достигнув нормальной стадии созревания. Применительно к эритроидному ряду, это явление называется неэффективным эритропоэзом, применительно к гранулоцитарному — не-
234
эффективным гранулопоэзом. Неэффективный гемопоэз охватывает от 2 до 10% эритробластов и от 10 до 15% костномозговых гранулоцитов. Их мембраны теряют сиаловые кислоты, отсюда отрицательный заряд их мембраны уменьшается, и макрофаги, располагающиеся на наружной поверхности костномозговых синусоидов, легко фагоцитируют эти клетки. В кровоток неполноценные клетки не поступают.
Особенности метаболизма кроветворной ткани. Массы костного мозга у взрослого человека составляет 4,6% от массы тела или около 3,4 кг, в том числе красного костного мозга около 1,7 кг. Общее количество ядросодержащих клеток достигает в среднем 8,1-109/кг массы тела, а занимаемый ими объем колеблется от 1320 до 4192 мл.
Дифференциация клеток костного мозга сопровождается' одновременно их многочисленными митозами, что делает его одной из наиболее пролиферируюших тканей организма. В делящихся клетках идет интенсивный синтез белков, характерных для развития клеточных линий крови: энзимов в гранулоцитах, гемоглобина в эритроб-ластах и т.д. Для осуществления митоза клетка использует энергию макроэргических соединений, образующихся в процессе окислительного фосфорилирования. Это объясняет наличие интенсивного энергообмена в ткани костного мозга и его усиление при повышении пролиферативной активности. Например, после кровопотери усиление эритропоэза всегда совпадает с активацией в костном мозге процессов аэробного окисления, увеличивается скорость потребления кислорода клетками, интенсивность дыхания и окислительного фосфорилирования в их митохондриях. Объемный кровоток в костном мозге увеличивается, благодаря раскрытию не функционирующих синусоидов, в результате укорачивается путь диффузии кислорода от отдельного сосуда к клетке.
Характерен спектр изоферментов в гемопоэтической ткани костного мозга после кровопотери: повышается активность аэробных изоферментов лактатдегидрогеназы, что способствует большему поступлению Ац КоА в цикл Кребса. При активации гемопоэза в костном мозге возрастает интенсивность синтеза ядерных и мито-хондриальных ДНК, РНК и белков, увеличивается количество митохондрий, поверхность их мембраны, обшее число рибосом, потребление свободных аминокислот. Например, усиление регенерации эритроцитов увеличивает потребление тканью костного мозга лизина, серусодержаших, ароматических аминокислот, глютаминовой кислоты, при их дефиците регенерация красной крови замедляется. Усиление пролиферации гемопоэтичеких клеток требует повышения проницаемости их мембран, что обеспечивается повышением интенсивности перекисного окисления липидов.
Между жировыми и гемопоэтическими клетками костного мозга существуют реципрокные отношения: резорбция жировой ткани предшествует активации и гранулоцитопоэза, и, особенно, эритропоэза. Высвобождающиеся из нее полиненасыщенные жирные кислоты локально реутилизируются в ходе гемопоэза для формирования клеток крови.
235
 2015-02-15
2015-02-15 1662
1662








