Полный магнитный момент атома определяется как векторная сумма орбитального 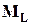 и спинового
и спинового 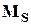 магнитных моментов. Составляющие
магнитных моментов. Составляющие 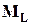 и
и 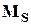 прецессируют вокруг направления полного механического момента атома J, который, как известно, сохраняется. Поэтому магнитным моментом атома
прецессируют вокруг направления полного механического момента атома J, который, как известно, сохраняется. Поэтому магнитным моментом атома 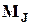 называют составляющую полного момента в направлении, параллельном
называют составляющую полного момента в направлении, параллельном 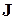 , поскольку среднее значение полного магнитного момента атома за конечный промежуток времени равняется
, поскольку среднее значение полного магнитного момента атома за конечный промежуток времени равняется 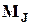 (рис. 5.12). Из векторной модели атома следует, что
(рис. 5.12). Из векторной модели атома следует, что
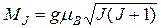 , (5.35)
, (5.35)
где 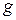 – множитель или фактор Ланде[5],
– множитель или фактор Ланде[5], 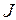 – полное (внутреннее) квантовое число атома,
– полное (внутреннее) квантовое число атома, 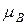 – магнетон Бора[6] (в СИ
– магнетон Бора[6] (в СИ 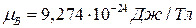 ).
).
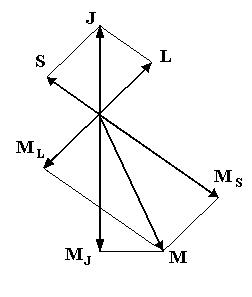 |
| Рис. 5.12. К определению магнитного момента атома |
Квантовое число 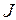 может принимать следующие значения:
может принимать следующие значения:
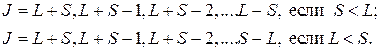
Множитель 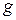 имеет чисто квантовомеханическую природу, характеризует связь орбитального и спинового моментов и определяется следующим выражением
имеет чисто квантовомеханическую природу, характеризует связь орбитального и спинового моментов и определяется следующим выражением
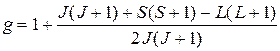 . (5.36)
. (5.36)
Для чисто орбитального момента 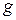 =1, для чисто спинового момента
=1, для чисто спинового момента 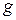 =2, в общем случае
=2, в общем случае 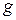 представляет собой дробную величину.
представляет собой дробную величину.
Следует помнить, что в полностью заполненных оболочках атомов как орбитальные, так и спиновые моменты полностью скомпенсированы. Поэтому при рассмотрении магнитного момента атома стоит учитывать только не полностью заполненные оболочки.
Для примера рассмотрим структуру атома железа (рис. 5.13). В зависимости от значения главного квантового числа электроны распределяются по четырем группам (слоям). Внутри каждой группы электроны распределены по оболочкам 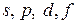 в соответствии со значениями орбитального момента. Оболочка может вместить два электрона, оболочка
в соответствии со значениями орбитального момента. Оболочка может вместить два электрона, оболочка 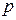 – шесть электронов, оболочка – десять электронов и т.д. Атомы, подобные железу, имеют незаполненную внутреннюю оболочку даже в том случае, когда заполняются последующие оболочки. Так, в атоме железа на оболочке
– шесть электронов, оболочка – десять электронов и т.д. Атомы, подобные железу, имеют незаполненную внутреннюю оболочку даже в том случае, когда заполняются последующие оболочки. Так, в атоме железа на оболочке 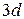 находится шесть электронов, хотя она может вместить десять. Причем спины этих электронов, согласно правилу Хунда, ориентированы таким образом, чтобы атом имел максимально большое число неспаренных спинов. Железо, кобальт и никель имеют незаполненную оболочку
находится шесть электронов, хотя она может вместить десять. Причем спины этих электронов, согласно правилу Хунда, ориентированы таким образом, чтобы атом имел максимально большое число неспаренных спинов. Железо, кобальт и никель имеют незаполненную оболочку 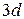 и соответственно четыре, три и два неспаренных спина. Они относятся к переходной группе металлов (группе железа).
и соответственно четыре, три и два неспаренных спина. Они относятся к переходной группе металлов (группе железа).
Аналогичные случаи имеют место при незаполненных 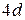 и
и 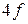 оболочках (группы палладия и редких земель), оболочке
оболочках (группы палладия и редких земель), оболочке 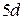 (группа платины), оболочке
(группа платины), оболочке 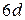 (актиноиды).
(актиноиды).
Таким образом, постоянный магнитный момент атома определяется магнитным моментом некомпенсированных электронных спинов. Вклад орбитального момента в магнитный момент атома обычно является очень малым.
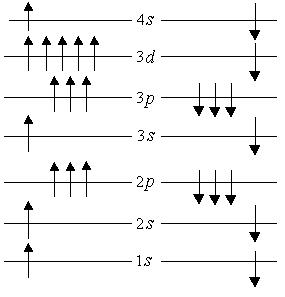 |
| Рис. 5.13. Схема заполнения электронных оболочек атома |
Вещества, атомы которых не обладают постоянным магнитным моментом, являются диамагнетиками. Вещества, атомы которых обладают постоянным магнитным моментом, разделяются на следующие:
парамагнетики, если взаимодействие между соседними атомами слабое и магнитные моменты ориентируются случайным образом (хаотически);
ферромагнетики, если соседние магнитные моменты выстраиваются параллельно друг другу;
антиферромагнетики, если соседние магнитные моменты выстраиваются антипараллельно;
ферримагнетики, если соседние магнитные моменты антипараллельны и величина их различна.
 2015-03-22
2015-03-22 1290
1290
