Ультрафиолетовая (УФ-) спектроскопия позволяет исследовать взаимодействие ультрафиолетового излучения с электронным облаком молекул. Для аналитических целей используется диапазон ультрафиолетового излучения
в пределах 10-8 – 4×10-7 м.
Так как энергия квантов ультрафиолетового излучения близка к энергии электронов, то при облучении молекул происходит возбуждение электронов и они переходят на разрыхляющие (нестабильные) молекулярные орбитали
с более высокой энергией. На диаграмме (рис. 3.4) показаны переходы s -, n- и p-электронов на разрыхляющие орбитали (где n- переходы неподеленных пар гетероатомов).
- 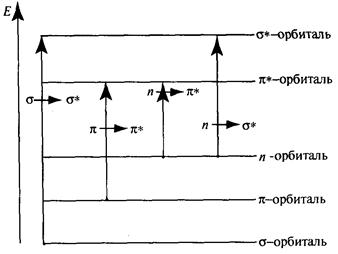
Рис. 3.4. Переходы s -, n- и p -электронов на разрыхляющие орбитали
Через s®s * обозначается переход s - электронов со связующей на разрыхляющую s*-орбиталъ. s-Электроны – это гибридизованные электроны, участвующие в образовании простых С–С- и С–Н-связей. Они близко расположены к ядру, прочно с ним связаны, и для их перехода на разрыхляющую s -орбиталь необходима большая энергия. Такой энергией обладают ультрафиолетовые лучи с длиной волны менее 160 нм (труднодоступная область ультрафиолетового излучения – вакуумный ультрафиолет). Так как в образовании связей в молекулах алканов и нафтенов участвуют только
s-электроны, то ультрафиолетовые спектры для этих углеводородов не характерны.
Через p®p* обозначается переход p-электронов двойных связей непредельных и ароматических углеводородов на разрыхляющие p *- орбитали;
p-электроны слабее, чем s-электроны, связаны с ядром, и для их возбуждения и перехода на разрыхляющие орбитали требуется меньшая энергия. Так, олефины поглощают ультрафиолетовое излучение в области 170 – 180 нм, а диены и ароматические углеводороды - в области еще более длинных волн (> 200 нм). Таким образом, диеновые и ароматические углеводороды дают характерные ультрафиолетовые спектры в области 200 – 400 нм.
В случае гетероатомных соединений нефти (кислородные, сернистые, азотистые соединения) алифатического ряда УФ-спектры возникают в результате n ®s* перехода неподеленных пар электронов гетероатомов. Полосы поглощения для гетероатомных соединений нефти находятся в коротковолновой области.
Если гетероатом находится рядом с двойной связью или ароматическим ядром, то поглощение происходит в области 200 – 300 нм (переход n ®p*).
Энергия квантов ультрафиолетового излучения в 20 раз больше энергии квантов инфракрасного излучения и приближается к величине энергии, необходимой для разрыва связей в молекулах органических соединений. Поэтому ультрафиолетовое излучение сильно возбуждает молекулы органических соединений и ультрафиолетовые спектры представляют собой довольно грубую картину в отличие от тонкой структуры инфракрасных спектров.
Ультрафиолетовые спектры записываются в форме зависимости логарифма молярного коэффициента поглощения lg e от длины волны l.Молярный коэффициент поглощения e является коэффициентом в уравнении Бугера – Ламберта – Бера. Кривая УФ-спектра имеет один или несколько максимумов поглощения, которые характеризуются соответствующими длинами волн lmах. Из рис. 3.5, на котором приведен УФ-спектр нафталина (1) и антрацена (2), видно, что lmах, соответствующие максимумам поглощения антрацена, смещены в длинноволновую часть спектра по сравнению с нафталином. Это объясняется тем, что в молекуле антрацена число сопряженных двойных связей больше, чем в молекуле нафталина. Известно, что с увеличением длины цепи сопряжения в молекуле облегчается переход p®p*. Так как для такого перехода требуется меньшая энергия, поглощается волна большей длины.

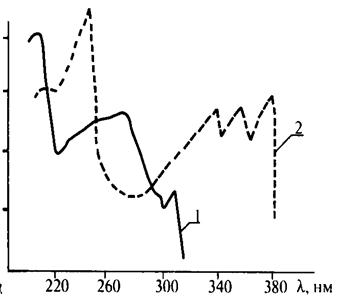
Рис. 3.5. УФ-спектр нафталина (1) и антрацена (2)
Введение алкильных групп в бензольное ядро вызывает сдвиг обеих полос поглощения для бензола в длинноволновую область спектра. Для смесей алкилбензолов максимум поглощения лежит в области 255 – 275 нм. Для алкилнафталинов максимум поглощения находится в области 275 – 290 нм; в области 310 – 330 нм имеются также два характерных максимума. Для алкилпроизводных антрацена и фенантрена характерны широкие полосы поглощения с несколькими максимумами в области 310 – 380 нм и 280 – 310 нм.
3.5.2. Масс-спектроскопия
В последние годы для структурных исследований молекул органических соединений используют масс-спектроскопию, основанную на ионизации молекул электронным ударом.
Для получения масс-спектра пары вещества в глубоком вакууме
(1,3 × 10-5 – 10-7 Па) бомбардируют пучком электронов средних энергий (25 – 70 эВ). При этом из молекул «выбивается» один электрон, возникает сильно возбужденный молекулярный ион, который далее претерпевает ряд последовательных превращений с образованием положительно заряженных ионов и радикалов. В масс-спектре каждому иону соответствует отдельный пик.
Масс-спектрометр – это прибор, который позволяет разделять ионы, полученные бомбардировкой молекул электронами: разделение ионов происходит по их массам. Схема прибора приведена на рис. 3.6.
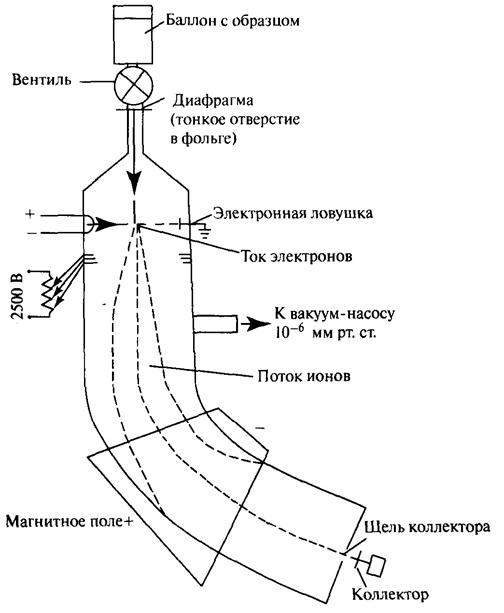
Рис. 3.6. Схема масс-спектрометра
Пары образца из баллона поступают через диафрагму в вакуумированную камеру (остаточное давление 10-6 мм рт. ст.), где сталкиваются с потоком электронов, движущихся от катода (накаленная нить) к электронной ловушке (земля). Электроны выбивают из молекул орбитальные электроны
и превращают молекулы в ионы.
Кроме электроноударного метода ионизации молекул в химии нефти для высокомолекулярных нефтяных компонентов, обладающих низкой химической стабильностью, применяется метод полевой ионизации (ионизации под действием сильного неоднородного электрического поля). Развитием полевой ионизации является метод полевой десорбции: образец наносится на острие вольфрамового эмиттера, помещенного в сильное неоднородное электрическое поле, и эмиттер медленно нагревается электрическим током. Вследствие туннелирования наиболее подвижных электронов в эмиттер происходит ионизация молекул, и образующиеся молекулярные ионы десорбируются в газовую фазу. Ионы под действием возрастающего электрического поля, приложенного к сеткам ионной пушки, втягиваются в ионную пушку и ускоряются. Диаметр диафрагм сеток увеличивается по ходу движения ионов, поэтому ионы образуют расходящийся пучок, который попадает в магнитное поле. Нейтральные молекулы выводятся из камеры с помощью вакуумного насоса.
Изменяя напряженность магнитного поляили скорость движения ионов, можно поочередно фокусировать ионы различной массы на коллектор (с помощью щели ~0,1 мм). Образующийся при этом ионный ток усиливается и подается на записывающее устройство.
На рис. 3.7 приведен общий вид масс-спектрограммы. На оси абсцисс откладывается отношение массы иона m к его заряду z. Последний пик соответствует самому тяжелому молекулярному иону, который образуется при отщеплении от молекулы одного электрона. Остальные пики соответствуют осколочным ионам, образующимся при распаде молекулярного иона.
|
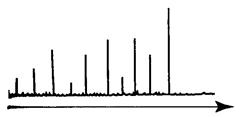
Рис. 3.7. Общий вид масс-спектрограммы
Рассмотрим упрощенную схему масс-спектрального распада изопропилбензола:
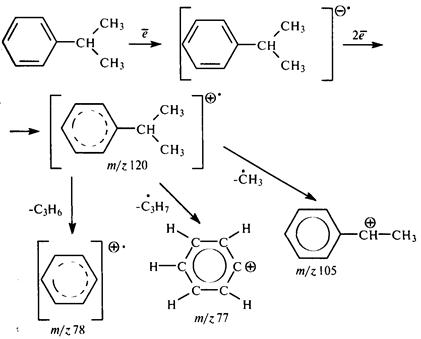
Молекула изопропилбензола под действием электронного удара превращается в анион-радикал, затем – в катион-радикал, распад которого приводит к положительным осколочным ионам различной массы.
С помощью масс-спектроскопии в химии нефти можно определить:
– молекулярную массу углеводорода или гетероатомного соединения;
– элементный состав вещества. Для этого с помощью приборов с высокой разрешающей способностью необходимо вычислить молекулярную массу вещества с точностью до 10-3 – 10-4. По масс-спектру вещества определяют его структурную формулу, для чего следует идентифицировать осколочные ионы по их массам и по фрагментам молекулы воссоздать ее структуру;
– качественный и количественный состав углеводородных смесей.
Количественный состав простых смесей нескольких веществ можно установить на основании интенсивности пиков молекулярных ионов. На основании данных калибровочных графиков в координатах интенсивность пика – процентное содержание компонента по масс-спектрограмме смеси неизвестного состава определяют процентное содержание каждого компонента в смеси.
В последние годы при исследовании нефтей применяется метод хромато-масс-спектрометрии. Этот метод предполагает использование газового
хроматографа в блоке с масс-спектрометром и ЭВМ. В хроматографе происходит разделение углеводородов, которые затем поступают в масс-спектрометр; данные масс-спектра поступают в ЭВМ, которая расшифровывает спектр и идентифицирует углеводород.
Для исследования гетероатомных соединений нефти применяют масс-спектроскопию отрицательных ионов. В отличие от масс-спектрометрии положительных ионов,молекулы анализируемого вещества в данном случае подвергаются бомбардировке электронами низкой энергии (»3 эВ), которые захватываются молекулами гетероатомных соединений с образованием
анион-радикалов. Отсюда другое название этого вида масс-спектроскопии – масс-спектроскопия электронного захвата.
Анион-радикал, образовавшийся в результате захвата электрона молекулой вещества (молекулярный ион) распадается с образованием радикалов, анионов и анион-радикалов.
В качестве примера рассмотрим схему масс-спектрального распада нефтяного сульфида (этилпропилсульфида):
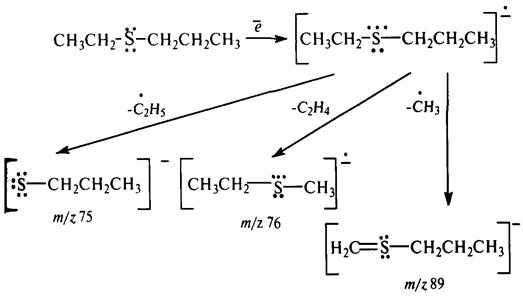
Углеводороды не поглощают электроны низкой энергии, поэтому масс-спектроскопическое исследование гетероатомных соединений можно проводить, не выделяя их из нефтяной фракции в чистом виде.
3.5.3. Спектроскопия ядерного магнитного резонанса
Кроме массы и заряда, ядро обладает третьей характеристикой – моментом количества движения, который обусловлен его вращением вокруг оси – спином. Поскольку ядро заряжено, его вращение вокруг собственной оси приводит к круговому движению заряда ядра, что формально аналогично круговому электрическому току (рис. 3.8).
Круговой ток создает магнитное поле, так что вращающееся ядро подобно крошечному магниту, ось которого совпадает с осью спина, поэтому ядро может характеризоваться магнитным дипольным моментом. Ядра, имеющие четный заряд (порядковый номер) и четное массовое число, не обладают магнитным моментом. У ядер, имеющих нечетный заряд, но четное массовое число, магнитный момент I = 1 (например, ядра азота). У ядер, имеющих нечетный заряд и нечетное массовое число, магнитный момент
I = 1/2 (ядра водорода, фтора, фосфора). Ядра изотопа углерода 13С6 и изотопа кремния 29Si14 также имеют нечетное массовое число и четный заряд.

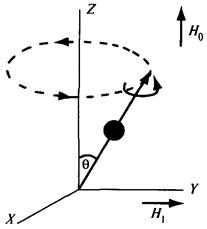
Рис. 3.8. Круговое движение Рис. 3.9. Движение ядра
заряда ядра в магнитном поле
Рассмотрим ядро, магнитный диполь которого ориентирован под некоторым углом Q к направлению силовых линий постоянного магнитного поля Н0 (рис. 3.9). Это поле обусловливает появление силы, стремящейся расположить ядро-магнит вдоль поля. Но, поскольку ядро вращается и обладает моментом количества движения, оно сопротивляется этому воздействию. В результате этого наблюдается прецессия магнита-ядра: кроме вращения вокруг своей оси, ядро вращается вокруг направления постоянного магнитного поля, подобно тому, как прецессирует волчок, если он наклонен по отношению к силовым линиям гравитационного поля Земли. Угловая скорость этой прецессии w (в рад/с) не зависит от угла Q, но зависит от напряженности постоянного магнитного поля H 0:
w = g Н 0,
где g – гиромагнитное отношение, в которое входит ядерный магнитный момент.
Рассмотрим влияние небольшого магнитного поля напряженностью Н 1, перпендикулярного к постоянному магнитному полю Н 0,на движение ядра в магнитном поле.Последнее стремится отклонить диполь (ось спина) в плоскость XY,однако действие поля незначительно. Если же поле Н 1 начнет вращаться вокруг направления линий магнитного поля Н 0 (т. е. если оно будет переменным), то, когда частота этого поля достигнет частоты прецессии ядра, произойдет поглощение ядром кванта энергии. Это поглощение называется резонансным.
Тот же самый результат может быть получен, если частота переменного поля остается постоянной, а изменяется напряженность постоянного магнитного поля. При изменении напряженности постоянного магнитного поля изменяется частота прецессии ядра, и, когда она достигает частоты переменного магнитного поля, происходит резонанс. Задача спектроскопии ядерного магнитного резонанса состоит в том, чтобы определить напряженность постоянного магнитного поля, при которой наступает резонанс ядер исследуемого образца в переменном поле определенной частоты n. В этом случае частота n равна частоте ядерного магнитного резонанса (ЯМР). В табл. 3.2 приведены значения ЯМР для ядер различных атомов. Из таблицы следует, что ядра кислорода и углерода, спин которых равен нулю, не являются магнитными, поэтому они не способны к ядерному магнитному резонансу.
Таблица 3.2
 2015-03-22
2015-03-22 11635
11635








