1. Записать уравнение химической реакции и условия задания в соответствии с номером варианта (прил. 1).
аА + вВ ↔ сС + dD
Температура:_______
Масса (или объем):_______
2. Выписать значения ΔН0обр. и S0. для исходных реагентов и продуктов реакции (прил. 2):
| Вещество | ΔН0обр, кДж/моль | S0, Дж/моль·K |
| A | ||
| B | ||
| C | ||
| D |
3. Применив следствие закона Гесса, рассчитать стандартное изменение энтальпии реакции
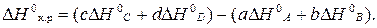
4. Вычислить изменение энтропии реакции в стандартных условиях:
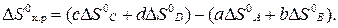
5. Пользуясь соотношением 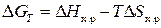 , вычислить изменение потенциала Гиббса при стандартной температуре 298 К.
, вычислить изменение потенциала Гиббса при стандартной температуре 298 К.
6. Вычислить ΔGТ при заданной температуре, полагая, что ΔН0 и ΔS0 не зависят от температуры
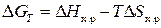
7. Используя полученные значения 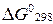 и
и 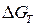 , рассчитать константу химического равновесия (Kр) при 298 К и заданной температуре из уравнения:
, рассчитать константу химического равновесия (Kр) при 298 К и заданной температуре из уравнения:
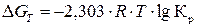
8. Определить температуру, при которой наступает состояние химического равновесия при 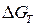 = 0.
= 0.
При химическом равновесии 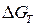 = 0, следовательно, |
= 0, следовательно, | 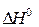 | = |
| = | 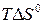 |. Таким образом,
|. Таким образом, 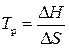 .
.
9. Рассчитать количество теплоты, поглощенной или выделенной в ходе реакции на заданный объем (массу или количество) вещества:
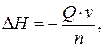
где Q – тепловой эффект реакции; n – стехиометрический коэффициент (заданного вещества); ν – количество вещества, 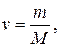 здесь m – заданная масса вещества, М – молярная масса вещества
здесь m – заданная масса вещества, М – молярная масса вещества
или
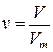 ,
,
где V – заданный объем газообразного вещества; Vm – молярный объем газа (22,4 моль/л).
10. Сделать вывод, является ли рассматриваемая реакция самопроизвольной в прямом направлении. Проанализируйте влияние величины 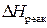 ,
, 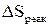 и изменения температуры на величину
и изменения температуры на величину 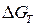 .
.
 2015-03-22
2015-03-22 832
832








