Наука рассматривает химическое вещество как основной, наряду с физическим полем, вид материи, составляющей любое физическое образование, т. е. все, что занимает пространство и имеет твердое, жидкое или газообразное агрегатное состояние.
Вещество – совокупность взаимодействующих частиц (атомов, молекул, ионов и т. д.), расположенных определенным образом в пространстве и связанных между собой некоторыми силами. Состав и форма частиц, их пространственное распределение, природа и особенности химической связи определяют все физические и химические свойства.
Наименьшей частицей вещества, еще сохраняющей его химические свойства, является атом, т. е. атом – это предел химического разложения любого вещества. Атом – это система взаимодействующих элементарных частиц, состоящая из ядра и электронов.
Все виды известных науке атомов содержит Периодическая система химических элементов Д. И. Менделеева. Атомы одного элемента идентичны. Химические соединения образуются при взаимодействии атомов двух и более элементов. Причиной периодичности в изменении свойств атомов является послойное заполнение электронами пространства вокруг ядра, заряд которого равен номеру элемента в Периодической системе.
Строение атома. Протоны и нейтроны (нуклоны) составляют заряженное ядро атома (заряд ядру придают протоны, тогда как нейтроны электрически нейтральны), а отрицательно заряженные электроны вращаются по своим орбитам вокруг ядра (рис. 5).

Рис. 5 Планетарная модель атома Э. Резерфорда
Каждый химический элемент – это физическое образование из атомов с одинаковым числом протонов (данное число определяет атомный (порядковый) номер элемента в Периодической системе). Масса атома сосредоточена в ядре, при этом масса электрона очень мала в сравнении с массой ядра. Масса атомов колеблется в пределах 10-24 – 10-22 г, диаметр составляет 0,1 – 0,5 нм (1 нм = 10-9 м).
Отрицательно заряженные электроны в системе атома притягиваются положительно заряженными ядрами и вращаются вокруг них по строго определенным энергетическим орбитам, т. е. находятся на стационарных энергетических уровнях, называемых электронными оболочками или орбиталями. Атом электрически нейтрален, так как заряд положительного ядра скомпенсирован суммарным отрицательным зарядом электронов. Следовательно, каждый атом вещества – это сложная энергетически уравновешенная система, по совокупности определяющая параметры состояния каждого вещества – его удельный объем, плотность, концентрацию, внутреннюю энергию, энтропию и пр.
Атомарный уровень структуры определяет все свойства химического элемента, в том числе его цвет. Цвет материала можно использовать при визуальном анализе. По цвету можно отличить золото от серебра, однако сложно отличить медь от золота, поскольку их цвета схожи. Тогда для идентификации химических элементов следует воспользоваться другими методами анализа, например, определить их плотность (золото при 20оС имеет плотность 19,3 г/см3, а медь – 8,9 г/см3) или исследовать их химическое взаимодействие с азотной кислотой: медь с ней взаимодействует, а золото на нее не реагирует, хотя в смеси азотной и соляной кислот в соотношении 1:3 («царская водка») золото хорошо растворяется.
Атомарная модель дает представление также о типе химической связи – взаимном сцеплении атомов вещества под действием электростатических сил притяжения и, как следствие, о характере строения вещества, его атомарной структуре. Химическая связь между элементарными частицами – первопричина различий в свойствах веществ.
Молекула – это группа взаимосвязанных атомов, микрочастица, обладающая свойствами химического вещества, способная существовать самостоятельно. Образование молекулы из атомов энергетически выгодно. Совокупность атомов и молекул образует твердое, жидкое или газообразное вещество.
Молекулы простого вещества могут содержать разное число атомов. Например, гелий Не, аргон Аr, неон Ne – одноатомные молекулы простых газов; водород Н2, азот N2 и кислород О2 – двухатомные. Молекулы сложного вещества содержат атомы разных видов: оксид углерода (угарный газ) СО – это двухатомная молекула сложного вещества, а диоксид углерода (углекислый газ) СО2 и вода Н2О – это трехатомные молекулы сложного вещества. Молекула аммиака NН3 построена из четырех атомов, а молекула метана СН4 – из пяти.
Атомы в молекулах объединяются за счет химических связей. Под химической связью понимают силы, удерживающие атомы в молекуле – структуре со стабильной электронной конфигурацией.
Межатомное взаимодействие. Основной принцип межатомных взаимодействий: атом стремится к устойчивой конфигурации, чтобы на его внешней оболочке располагалось восемь электронов, что соответствует конфигурации благородного газа (например, гелия Не). В этом случае атом не взаимодействует с другими атомами. Элементы, электронная конфигурация которых не совпадает с конфигурацией благородного газа, при взаимодействии способны отдавать, принимать или обобществлять валентные электроны внешнего уровня.
Обычно атомы испытывают взаимное притяжение или отталкивание. Сила связи F св двух и более атомов обусловлена энергией их взаимодействия Е вз и пропорциональна сумме энергий взаимного притяжения Е пр или отталкивания Е от:
F св ≈ Е св = Е пр + Е от.
Устойчивость жидкого и твердого состояния обусловлена тем, что на определенном расстоянии атомов друг от друга силы притяжения и силы отталкивания уравновешиваются. При этом устанавливается минимальная потенциальная энергия связи атомов Е 0. Прочность взаимодействии атомов определяется величиной Е 0 и природой межатомных взаимодействий.
Если энергия взаимодействия двух разноименных атомов А и В меньше суммарной энергии изолированных атомов (Е АВ < Е А + Е В), то между атомами преобладают силы притяжения, и новое вещество, состоящее из А и В, является устойчивым.
Энергию химической связи атомов двух простых веществ определяют из выражения:
Е 0 = (Е А + Е В) – Е мол,
где (Е А + Е В) – сумма энергий свободных атомов; Е мол – энергия молекулы АВ. Если Е 0 – величина положительная, то образование молекулы АВ из свободных элементов возможно, происходит химическая реакция типа А + В = АВ.
Взаимосвязь атомов в кристаллических и аморфных телах имеет электрическую природу, но проявляется по-разному. В зависимости от строения внешних электронных орбит атомов между ними возможна реализация межатомной связи по нескольким основным вариантам. Известны следующие основные типы межатомных связей: ионная, ковалентная, металлическая, а также молекулярный тип связи. Разделение материалов по типу связи достаточно условно, так как во многих материалах действуют одновременно несколько типов связи. Обычно для характеристики вещества имеют в виду преобладающий тип связи.
Ионная (гетерополярная) связь атомов в молекулах обусловлена взаимным притяжением положительно и отрицательно заряженных ионов, между которыми действуют электрические (кулоновские) силы притяжения, удерживающие их в определенном положении. Ионы образуются в результате перехода электронов от одних атомов, имеющих меньшее число валентных электронов, к атомам другого рода с большим числом электронов. Оба элемента приобретают конфигурацию благородного газа, теряя при этом нейтральность. Ионная связь – наиболее простая из всех типов связей и достаточно сильная, возникает, как правило, между атомами металла и неметалла.
При ионной связи каждый атом, представляющий собой заряженную частицу (ион), стремится приблизить к себе противоположно заряженные ионы. Энергия ионной (электростатической) связи разноименных элементов достаточно велика. Она больше энергии взаимодействия одноименных элементов: Е АВ > Е АА и Е АВ > Е ВВ.
Схему силовых и энергетических взаимодействий атомов в кристалле с ионным типом межатомных связей (а) и атомов простых веществ АА и ВВ (б, в) можно изобразить так:
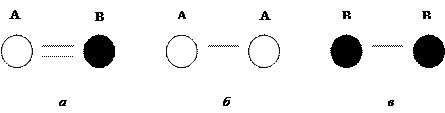 |
и записать Е АВ > (Е А + Е А) и Е ВА > (Е В + Е В).
Плоскость элементарной кристаллической решетки (ячейки) вещества выглядит следующим образом:
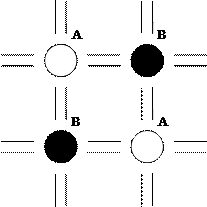
Типичным примером вещества с ионным типом связи является поваренная соль NaCl, при образовании молекулы которой атом натрия теряет электрон внешней оболочки и становится положительным ионом натрия – катионом, а атом хлора присоединяет данный электрон, становясь отрицательным ионом – анионом. Перераспределение электронов при ионной связи приводит к созданию вещества со стабильной электронной структурой, имеющей конфигурацию благородного газа. Наиболее известный и широко распространенный материал с ионным типом связи – стекло. Ионная связь характерна для молекул галоидно-водородных соединений и соединений щелочных металлов: NaCl, HCl, NaBr, КOH и др., а также различных оксидов состава МеxOy.
Твердые тела с ионным типом связи разноименных атомов обычно обладают значительной прочностью, твердостью, высокой температурой плавления, малым коэффициентом термического расширения. Кристаллы с ионной связью атомов хрупки. Эти материалы не могут быть электропроводящими, так как электроны внешних орбит в атомах связаны между собой силами электростатического взаимодействия. Поэтому все ионные кристаллы (например, поваренная соль NaCl) являются изоляторами (диэлектриками).
Ковалентная связь. Если конфигурацию благородного газа нельзя достичь путем обмена электронами, так как их сумма не достигает восьми, то стабильного сочетания атомов в молекуле можно достичь путем образования общих электронных пар. Ковалентная связь принципиально отличается от ионной тем, что она устанавливается путем слияния, соединения внешних валентных электронов, а не передачей их от одного атома к другому. Обобществленные электроны, осуществляющие ковалентную связь, частично принадлежат обоим атомам, которые приобретают таким образом конфигурацию благородного газа. Локализация электронов создает резко направленный характер связи.
Ковалентная связь осуществляется путем частичного перекрывания внешних электронных оболочек. Она устанавливается не только между одинаковыми элементами (молекулы Н2, Cl2 и др., где связь неполярная), но и между разными элементами. Так, в соединениях типа карбидов (SiC и др.) и нитридов (AlN и др.) существует ковалентная связь. К образованию ковалентных связей склонны атомы III - V групп Периодической системы элементов. Примеры веществ с ковалентной связью – элементы углерод С, кремний Si, германий Ge и др. Характерными свойствами тел с ковалентным типом связи являются высокая твердость (алмаз, карбиды, нитриды), хрупкость, износостойкость и пр.
Материалы с ковалентным типом связи широко применяются при производстве полупроводников и разных высокопрочных сплавов. Ковалентная связь атомов является важной в формировании полимерных соединений и материалов на их основе.
Кристаллы с ковалентным и ионным типом связи можно рассматривать как предельные случаи, тогда между ними располагаются кристаллы с промежуточным типом связи.
Металлическая связь. Металлы относятся к простым веществам и в обычных условиях являются (за исключением ртути) кристаллами с особыми свойствами, обусловленными металлической связью.
Если число валентных электронов меньше четырех, то достичь конфигурации благородного газа за счет образования электронных пар даже в трехмерной структуре невозможно. Металлическая связь атомов наиболее сложная и состоит из рассмотренных выше, но несколько измененных типов связей: ионной и ковалентной. Она реализуется в кристаллах разных металлов и не имеет аналогов в двухатомных молекулах.
Атомы металлов не имеют на внешних оболочках достаточного количества валентных электронов для образования обычных ковалентных связей со всеми ближайшими атомами кристаллической решетки. В то же время атомы в металлических кристаллах настолько сближены, что орбиты их внешних электронов перекрываются не с одним, а с большим числом атомов. Такое сближение возможно только в случае установления ионной связи или ковалентной связи, но электронами нижележащего (второго от поверхности) уровня. В этом случае электроны внешних орбит (валентные) могут легко переходить от одного атома к другому. Эти обобществленные электроны получили название «электронный газ».
Электростатическая по природе взаимосвязь электронного газа и устойчивой ионной структуры кристаллической решетки, имеющей положительный заряд, формируется, следовательно, обычными ионными или ковалентными связями с участием электронов не внешнего, а нижележащего уровня. Это коллективное ионно-электронное взаимодействие в металле дополнительно повышает его прочность. Электронный газ, несущий отрицательный заряд, связывает в прочную систему положительно заряженные ионы металла. Без «цементирующего» действия электронного газа одноименно заряженные ионы металла должны были бы удаляться друг от друга под действием кулоновских сил отталкивания, что привело бы к разрушению кристалла.
Кроме того, действуя объемно, т. е. образуя дальние связи во всем объеме кристалла, коллективное ионно-электронное взаимодействие не позволяет разрушаться металлическому материалу без предварительной пластической деформации. Пластичность (ковкость) можно объяснить именно коллективным для всех атомов металлического вещества взаимодействием электронного газа и ионной массы атомов кристаллической решетки. Электронный газ обеспечивает также электропроводность, электромагнитную проницаемость и увеличивает теплопроводность металлических материалов.
При ковалентном взаимодействии валентные электроны локализованы на атомах (около ядра), а при образовании металлической связи электроны формально принадлежат всем атомам. Столь слабая привязка к атомам объясняет слабость металлической связи по сравнению с другими типами. Особенности кристаллической структуры металлических материалов, а также поляризация света поверхностью являются причиной своеобразного блеска и хорошей отражательной способности их поверхности.
Схематичное изображение разных видов связи показано на рис. 6, а характеристика межатомного взаимодействия – в табл. 2.

Рис. 6 Схематичное изображение разных видов связи: а – ковалентная; б – ионная; в – металлическая
Таблица 2
Характеристика типов химической связи в веществах
| Тип связи | Процессы взаимодействия |
| Ковалентная | Обобществление пары электронов двух атомов |
| Ионная | Электростатическое притяжение между разноименно заряженными ионами |
| Металлическая | Обобществление электронов в объеме кристалла |
Молекулярный тип связи. Между молекулами могут возникать водородные (химические) связи и силы Ван-дер-Ваальса (физические).
Водородная связь образуется между положительно заряженным атомом водорода Н одной молекулы и отрицательно заряженным атомом (О, S, N) другой молекулы, т. е. в полярных молекулах. Малые размеры протона водорода не позволяют ему иметь ближайшими соседями более чем два атома, поэтому водородная связь осуществляется только между двумя атомами. Энергия ее невелика, но она играет большую роль в формировании свойств веществ: повышает температуру кипения и температуру плавления, объясняет жидкое (а не газообразное) состояние воды в нормальных условиях и особые физические свойства воды и льда. Водородная связь имеет важное значение в химических и биологических процессах: определяет размеры и геометрическую структуру белковых молекул, образование двухспиральной молекулы ДНК (дезоксирибонуклеиновой кислоты) и пр.
Связь Ван-дер-Ваальса не связана с обменом электронов. Физическая природа связи заключается в том, что свойством всех атомов является поляризация вследствие наличия у них электрических диполей или способности электронных оболочек деформироваться под влиянием дальнего (а поэтому слабого) электромагнитного взаимодействия атомов. Появление электрических диполей в электронных оболочках приводит к установлению между атомами и молекулами устойчивой взаимосвязи.
Полярность связи обусловлена смещением общей пары электронов связи к более электроотрицательному атому. При одинаковой (или близкой) электроотрицательности образуется неполярная связь (молекулы Cl2, Н2), атомы с разной электроотрицательностью образуют ковалентную полярную связь и полярные молекулы – диполи. Диполь – это система, состоящая из двух равных по величине, но противоположных по знаку зарядов, расположенных на некотором расстоянии. Полярность связи оценивается дипольным моментом μ = q * l, где q – величина заряда, l – длина диполя.
Дипольное взаимодействие атомов возникает вследствие того, что в диполе центры тяжести положительного ядра и отрицательной электронной оболочки не совпадают (рис. 7). Это приводит к возникновению дипольного момента атома, который притягивает другие атомные диполи. Если атомы или молекулы вещества являются электрическими диполями, то они соединяются, располагаясь относительно друг друга так, чтобы положительный заряд диполя одного атома подходил к отрицательному заряду другого. Таким образом достигается устойчивая взаимосвязь, механизм взаимодействия частиц называется ориентационным.
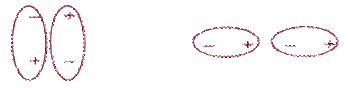
Рис. 7 Схематичное изображение ориентации диполей
Электростатическое взаимодействие диполей является физическим взаимодействием. Силы притяжения, действующие между частицами с полярным типом связи, называются силами Ван-дер-Ваальса, они обусловлены ориентационным, индукционным и дисперсионным взаимодействием диполей:
Е св = Е ориен + Е инд + Е дисп.
Мгновенные дипольные моменты создаются благодаря постоянному движению электронов и ядра атомов. Образующийся дипольный момент электрическим полем поляризует соседний атом или молекулу – появляется второй диполь и т. д.
Эти силы универсальны, так как действуют между любыми атомами, ионами и молекулами. Иногда силы Ван-дер-Ваальса называют молекулярными. При наличии сильных взаимодействий (например, при ковалентной связи) слабые молекулярные силы играют второстепенную роль небольшой добавки (они слабее химических связей в 10 – 100 раз). Однако в ряде случаев взаимодействие Ван-дер-Ваальса играет значительную и даже определяющую роль. Например, силы, удерживающие атомы хлора в молекуле хлора, почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Силы притяжения Ван-дер-Ваальса обеспечивают взаимодействие между атомами благородных газов или атомами, далеко расположенными друг от друга, когда непосредственный обмен электронами невозможен. Примерами веществ с молекулярным типом взаимодействий (связей) атомов и молекул являются Н2, СО2, Н2О, СН4, органические полимеры и др.
Ковалентная связь сильно зависит от ориентации в пространстве, так как электроны, образующие пары, располагаются таким образом, чтобы центр тяжести заряда оставался на ядре атома – образуется тетраэдр, угол связи между атомами составляет 109,5о (алмаз из атомов углерода С). Если связь образована между атомами разных элементов (например, в молекуле этилена С2Н4 с двойной связью), электронная структура искажается за счет атомов водорода, что приводит к линейному расположению молекулы мономера.
Ионная связь пространственно независима, возникает между атомами разных типов.
Современная квантовая теория не только объясняет строение и свойства атомов, но и позволяет на основе математического моделирования предсказать строение и свойства гипотетически возможных, но еще не открытых в природе веществ. Это дает возможность сокращать сроки разработки новых материалов и экономить средства за счет сокращения объема дорогостоящих натурных экспериментов.
Материалы с разным типом химической связи.
Тип химической связи определяет энергию связи, физическую природу материала (проводник или диэлектрик), физические и механические свойства, а также тип упаковки при образовании кристаллических структур.
В кристаллических телах химическая связь имеет смешанную природу с преобладанием одного из типов связи (табл. 3).
Таблица 3
Характеристика химической связи в материалах
| Материал | Природа связи | Примеры |
| Металлы | Металлическая | Железо и сплавы |
| Керамики, стекла | Ионная и ковалентная | Кремнезем SiО2 |
| Полимеры | Ковалентная, Ван-дер-Ваальса | Полиэтилен (С2Н4)n |
| Полупроводники | Ковалентная (неполярная и полярная) | Si, CdS |
Соединения между металлами характеризуются ковалентной составляющей, что важно для их формования. В полимерах ковалентные взаимодействия реализуются в цепочке, а между цепочками действуют силы Ван-дер-Ваальса; они достаточно сильны, чтобы полимеры могли кристаллизоваться.
От типа связи зависят величина энергии связи; физические, химические,механические и технологические свойства; плотность атомов в кристалле, а также способ получения материала.
Величина энергии связи Е св имеет наибольшее значение у материалов с ковалентной и ионной связью (табл. 4). Металлическая связь в 3 – 4 раза слабее.
Таблица 4
Энергия связи и физические свойства материалов
| Материал | Тип связи | Энергия связи Е св, кДж/моль | Температура плавления, оС | |
| Металлы | ||||
| Al | Металлическая | |||
| Fe | ||||
| Керамика | ||||
| Алмаз | Ковалентная | |||
| Si | ||||
| SiО2 | Ионная | |||
| Al2О3 | ||||
| WC | Ковалентно-металлическая | - | ||
| Полимеры | ||||
| Полиэтилен | Молекулярная | |||
| Эпоксидная смола | Молекулярно-ковалентная | |||
Такие свойства, как электро- и теплопроводность, определяются степенью «локализации-делокализации» электронов: если электроны локализованы у ядерных остовов, они не дают вклада в проводимость и материал является диэлектриком; если электроны делокализованы – проводником.
Другие физические свойства зависят от величины энергии связи следующим образом: температура плавления и модуль упругости пропорциональны энергии связи Е св, а коэффициент линейного расширения α – обратно пропорционален Е св.
Влияние типа связи на свойства наглядно проявляется при рассмотрении веществ одинакового химического состава. Так, двумя модификациями углерода являются алмаз и графит. Алмаз – вещество с ковалентным типом связи, самый твердый кристалл в природе, диэлектрик с высокой температурой плавления. Графит также имеет высокую температуру плавления. Однако для этого вещества характерен смешанный тип связи: в его структуре кроме атомов с ковалентным типом связи присутствуют атомы, между которыми действуют слабые нехимические молекулярные силы (силы Ван-дер-Ваальса). Этим объясняется очень низкая твердость графита, склонность к расслаиванию, электрическая проводимость и более высокий коэффициент линейного расширения α, чем у алмаза.
Эти состоящие из атомов углерода вещества с резко различающимися свойствами имеют разные пространственные структуры. В пространственной структуре алмаза атомы углерода организованы в объемную кубическую кристаллическую решетку, а в структуре графита кристаллическая решетка плоская гексагональная, что и предопределяет различие их свойств. Вещества, состоящие из одних и тех же атомов, но имеющие разные кристаллические решетки, образуют аллотропные модификации, их называют полиморфными, а их взаимные превращения – аллотропным (полиморфным) превращением. Полиморфизм – явление, при котором химические элементы в зависимости от температуры имеют разные кристаллические структуры. Такими элементами кроме углерода являются железо, олово, сера, фосфор и др.
Свойства материала, полученного из данного вещества с определенным кристаллическим строением, зависят от двух уровней структуры – надкристаллического и дисперсного. Изменяя структуру, из одного вещества можно получить материалы с различными свойствами.
В последние десятилетия открыта новая модификация углерода – фуллерен. Это молекулы углерода C60 или C70, для которых характерна неполная делокализация электронов, т. е. смешанный тип связи. Молекула фуллерена представляет собой углеродную оболочку диаметром примерно 1 нм со сравнительно большой внутренней полостью (рис. 8). Фуллереновые молекулы могут конденсироваться в молекулярные кристаллы. Кристалл фуллерит является полупроводником, имеет проводимость, промежуточную между алмазом и графитом.
Для отличия одного химического вещества от другого используют набор констант: атомная масса, плотность, температура плавления, температура кипения, термодинамические характеристики (в частности, запас внутренней энергии) и химические свойства.
Свойства веществ и материалов – это их характерные качества: цвет, твердость, пластичность, точка плавления, электропроводность,
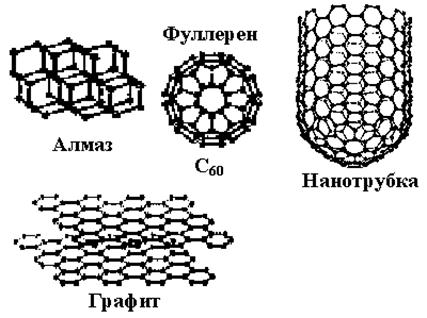
Рис 8 Модификации углерода
вкус и др. Для их определения пользуются Международной системой единиц СИ, в которой принята температурная шкала Кельвина с абсолютным нулем 0оК, равным минимальной температуре -273,15оС.
Рассмотрим различия в свойствах некоторых материалов.
Полимеры (молекулярный и молекулярно-ковалентный тип связи). Вещества с молекулярным типом связи имеют низкую энергию связи, низкую температуру плавления и являются диэлектриками. Из полимеров органической природы с молекулярным типом связи создают конструкционные материалы, которые находят широкое применение в разных областях. Свойства полимеров зависят от структуры молекул и взаимной укладки линейных молекул в веществе. Способ упаковки макромолекул (тип упорядочения во взаимном пространственном расположении макромолекул) называется надмолекулярной структурой.
Полимеры характеризуются прочной химической (ковалентной) связью в основной цепи макромолекул, при этом взаимодействие между цепями (межмолекулярное) является очень слабым (примерно в 10 – 50 раз), так как имеет физическую природу – молекулярный тип связи. Природными полимерами являются каучук, слюда, целлюлоза. На основе синтетических полимеров получают такие конструкционные материалы, как пластмассы. К ним относятся полиэтилен, фторопласт, полистирол и др.
Органическая природа этих материалов определяет их низкую плотность (1 – 2 г/м3), что является достоинством пластмасс по сравнению с другими материалами. Частично ковалентная связь определяет достаточную прочность, а молекулярный тип связи между цепями – меньшую трудоемкость при получении изделий. Так, для производства деталей из пластмасс необходим только один вид обработки (в отличие от сплавов металла) – формообразование детали методом пластической деформации.
Керамика (ковалентный, ионный тип связи). Конструкционные материалы из керамики представляют собой материалы с ковалентным, ионным и смешанным типом связи (техническая керамика); к приборным материалам относятся полупроводники.
Керамика – неорганический материал, получаемый в процессе обжига минеральных масс. Ее изготавливают при помощи операций порошковой металлургии: компактирование, спекание, горячее прессование. Окончательные размеры детали могут быть получены на этапе деформации, что исключает последующую механическую обработку.
Современные керамические материалы можно получать методом синтеза. Таким образом получают корунд Al2О3, кварц SiО2 и другие оксиды (TiО2 и др.). Керамические материалы подразделяют на бескислородные соединения типа металл-неметалл (SiС) или соединения металл-кислород (Al2О3). Для бескислородных соединений характерна ковалентная связь, а для оксидов – ионная связь; они придают этим материалам специфические свойства.
Керамика с обоими типами связи отличается от прочих материалов высокой твердостью за счет значительной величины энергии связи. Высокая твердость керамики обеспечивает повышенную износостойкость деталей в сравнении со сплавами.
Сильная направленность химической связи позволяет применять керамику как материал, практически не склонный к окислению при повышенных температурах. Высокая температура плавления обеспечивает керамике повышенную жаропрочность (в сравнении со сплавами). Так, бескислородная керамика применяется для деталей, эксплуатирующихся при температурах до 1300оС (нитрид кремния Si3N4) и до 1800оС (карбид кремния SiС). Керамика на основе оксидов СаО, Al2О3 и др., температура плавления которых превышает 2000оС, используется для получения жаростойких высокоогнеупорных материалов. Высокая твердость порошков является причиной большой трудоемкости изготовления деталей по сравнению со сплавами. К недостаткам изделий из керамики относятся пониженная пластичность и трудно устраняемая пористость.
Металлы и сплавы (металлический тип связи). В металлах реализуется практически только металлический тип связи. Поэтому они отличаются от материалов с ковалентным или ионным типами связи.
Ненаправленность связи и возможность перемещения электронов по орбиталям определяют такие свойства, как высокая теплопроводность и электропроводность. Делокализованность химической связи определяет возможность формирования в металлах плотноупакованных кристаллических структур, что отличает их от веществ с ковалентной и ионной связями. Наличие плотноупакованных структур в металлах определяет их повышенную пластичность при деформации. Образование некоторыми металлами неплотноупакованных структур связано с наличием ковалентных взаимодействий.
В результате более низкой энергии связи, чем у материалов с ковалентным или ионным типом связи, металлы имеют более низкий модуль упругости и температуру плавления (за исключением тугоплавких металлов), а также больший коэффициент линейного расширения α.
Чистые металлы имеют низкую прочность и во многих случаях не обеспечивают того уровня механических свойств, который необходим в эксплуатации. В качестве конструкционных материалов в большинстве случаев применяют сплавы, которые получают при добавлении в чистый металл (основу) разные химические элементы, называемые легирующими. На основе металлов создаются разнообразные сплавы с определенным комплексом свойств. Сплавы обладают физическими свойствами металлов, способностью к пластической деформации и другими свойствами.
Процесс производства деталей из сплавов отличается от производства керамик и пластмасс. После выбора химического состава сплава производится выплавка, разливка, при которой происходит затвердевание. К деформируемым сплавам применяют горячую и холодную деформации, затем механическую и термическую обработку в разных сочетаниях.
Основные преимущества сплавов перед керамиками и пластмассами:
- возможность получения разнообразного спектра свойств за счет легирования химическими элементами;
- возможность получения разнообразного спектра свойств за счет изменения технологии производства (при литье, горячей и холодной деформации, при термической обработке и поверхностной обработке деталей);
- технологичность в процессе получения деталей – при обработке давлением, механической обработке; сварке и т. п.;
- повышенные пластичность и ударная вязкость, обеспечивающие надежное применение деталей в эксплуатации;
- многообразие размеров и формы деталей;
- широкий диапазон рабочих температур; напряжений, рабочих сред;
- возможность получения материалов со специальными физическими свойствами: электрическими, магнитными, тепло физическими.
Композиционные материалы (композиты). Композиционный материал состоит из разнородных веществ, имеющих обычно разную химическую природу. В композите используют преимущества каждого из веществ, при этом достигается новый уровень свойств, не характерных для отдельных составляющих.
Композиты состоят из матрицы и наполнителя. Матрица объединяет в единое целое весь материал, передает внешнюю нагрузку на частицы наполнителя, защищает наполнитель от внешнего воздействия. В большинстве конструкционных материалов в качестве матрицы используют вещества с металлической и молекулярно-ковалентной связями: металлы и полимеры, что обеспечивает композитам определенный уровень пластичности.
Наполнителями являются обычно вещества с ковалентным или ионным типом связи – вещества высокотвердые и высокомодульные, которые обеспечивают высокий уровень прочностных свойств, намного превышающий уровень металлических сплавов. К ним относятся высокопрочные волокна углерода, бора, стеклянные нити, частицы оксидов, карбида и нитрида кремния и др. В связи с этим наполнители часто называют «армирующим веществом». Композиционные материалы используют в основном как высокопрочные и жаропрочные.
Применение материалов с разными типами связи определяется многими факторами: доступностью исходного сырья, трудоемкостью получения полуфабрикатов и изделий, многообразием возможностей изменения свойств материалов.
 2015-03-07
2015-03-07 4099
4099
