Задача 1. При обследовании работницы химчистки было обнаружено увеличение активности АЛТ в крови в 6, а АСТ в 2 раза. Обсуждая эти результаты, врач практикант А. связал активацию ферментов с избыточным употреблением мясных продуктов и решил, что особых причин для беспокойства нет, а нужно сделать повторный анализ. Практикант Б. предложил госпитализировать эту работницу, полагая, что у нее поражение печени органическими растворителями. Кто из врачей-практикантов прав и почему?
Ответ. Практикант Б. прав. Вследствие токсического действия органических растворителей могло произойти повышение проницаемости мембран клеток печени и выход ферментов в кровь.
Задача 2. У ребенка содержание в крови фенилаланина 5 мкмоль/мл (при норме 0,2 мкмоль/мл), с мочой выделяется большое количество этой аминокислоты. Назовите заболевание. Какие процессы обмена нарушены, как вскармливать ребенка?
Ответ. Фенилпировиноградная олигофрения. Нарушение обмена фенилаланина – дефект фенилаланингидроксилазы. Рекомендуется диета с исключением фенилаланина.
Задача 3. У больного наблюдались покраснение глаз и зуд при употреблении некоторых сортов яблок и орехов. В ходе обследования в крови пациента был установлен высокий уровень гистамина 1000 ммоль/л (норма 180–900 ммоль/л). Остальные показатели были в норме.
В чем причина повышения концентрации гистамина в крови и какие препараты применяют в этом случае?
Ответьте на вопросы:
а) напишите реакцию образования гистамина, механизм передачи сигнала, объясните его функции в организме;
б) при каких заболеваниях может повышаться концентрация гистамина в крови?
в) какие клетки в организме человека вырабатывают гистамин?
г) на чем основано действие антигистаминных препаратов?
ОТВЕТ:
Гистамин образуется способом декарбоксилирования гистидина в тучных клетках.
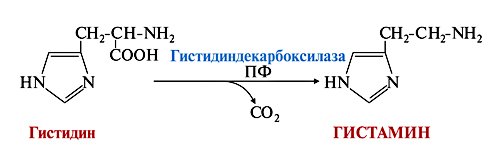
а) В организме существуют специфические рецепторы, для которых гистамин служит естественным лигандом. В настоящее время различают 3 подгруппы гистаминовых (Н) рецепторов: Н1-, Н2- и Н3-рецепторы. Возбуждение периферических Н1-рецепторов сопровождается спастическим сокращением бронхов, мускулатуры кишечника и другими явлениями. Наиболее характерно для возбуждения Н2-рецепторов усиление секреции желудочных желез. Они участвуют также в регуляции тонуса гладких мышц матки, кишечника, сосудов. Вместе с Н1-рецепторами Н2-рецепторы играют роль в развитии аллергических и иммунных реакций. Н2-рецепторы участвуют также в медиации возбуждения в ЦНС. В последнее время стали придавать большое значение стимуляции Н3-рецепторов в механизме центрального действия гистамина.
Биологическое действие гистамина:
• стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона)
• повышает проницаемость капилляров, вызывает отеки, снижает
АД (но увеличивает внутричерепное давление, вызывает головную
боль);
• сокращает гладкую мускулатуру легких, вызывает удушье;
• участвует в формировании воспалительной реакции;
• вызывает расширение сосудов, покраснение кожи, отечность ткани аллергическую реакцию;
• выполняет функцию нейромедиатора;
• служит медиатором боли.
б) Аллергические реакции увеличивают концентрации гистамина в крови. Гистамин секретируется в кровь при повреждении тканей (удар, ожог).
в) В организме гистамин присутствует во всех тканях и в основном хранится в метахроматических гранулах тучных клеток и в базофильных лейкоцитах (базофилах). В этих клетках он присутствует в неактивном связанном состоянии и высвобождается, когда клетка получает соответствующий сигнал.
г) Антигистаминные препараты (АП) – группа веществ, способных подавлять действие свободного гистамина. АП снимают вызываемый гистамином спазм гладкой мускулатуры бронхов и кишечника, уменьшают проницаемость капилляров, препятствуют развитию отека тканей, вызываемого им, облегчают течение аллергических реакций. Предполагают, что антигистаминная активность этих препаратов объясняется блокированием рецепторов гистамина на клетках гладкой мускулатуры и желез. Есть данные, что АП повышают активность гистидазы – фермента, способствующего распаду гистидина. Наряду с противогистаминным действием многие АП угнетающе влияют на центральную нервную систему, вызывают снотворный эффект, усиливают действие наркотических, снотворных, анальгезирующих и местноанестезирующих средств. Небольшое количество гистамина содержится в ЦНС, где он играет роль нейромедиатора.
Задача 4. Болезнь Хартнупа – наследственная ферментопатия обмена триптофана. Заболевание вызвано дефектом в структуре переносчика аминокислот щеточной каемки тощей кишки и нарушением реабсорбции триптофана и продуктов его обмена в почках. Патология проявляется мозжечковой атаксией, пеллагроподобными изменениями кожи, аминоацидурией, повышенным содержанием в моче индикана и индольных соединений. У больного возникает недостаток триптофана в организме и нарушается образование из него биогенного амина и одного из витаминов.
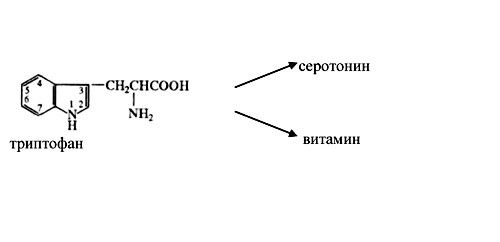
Рисунок 25.Образованиенекоторых биологически активных веществ из триптофана
Какие жизненно важные процессы нарушаются при данном заболевании?
Для ответа:
а) напишите схему синтеза серотонина и укажите, предшественником какого гормона он считается;
б) назовите витамин, который образуется из триптофана;
в) вспомните, в состав какого кофермента он входит;
г) приведите пример ферментов, для работы которых необходим этот кофермент.
ОТВЕТ:
а) Серотонин – биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. Мелатонин – гормон, регулирующий суточные сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции; регулирует состояния сон / бодрствование.
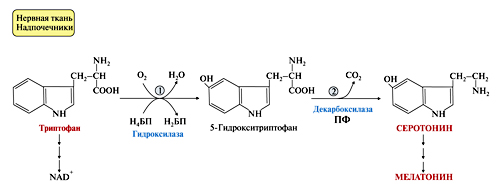
Рисунок 26. Образование серотонина и мелатонина из триптофана
б) Из триптофана синтезируется никотиновая кислота (витамин РР);
в) Из этого витамина образуется NAD+. Для его синтеза ферменты, находящиеся в цитозоле, используют никотиновую кислоту по следующей схеме: никотинат -> никотинат-мононуклеотид (NMN) -> дезамидо-NAD+ -> NAD+;
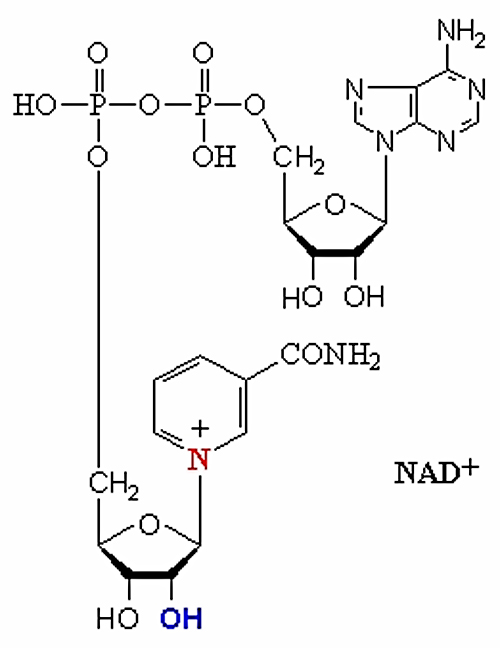
Рисунок 27. Структура НАД+
г) Примеры NAD+-зависимых дегидрогеназ:
| 1. | лактат-дегидрогеназа |
| 2. | дигидролипоат-дегидрогеназа (пируват/α-кетоглутарат-дегидрогеназный комплекс) |
| 3. | изоцитрат-дегидрогеназа, малат-дегидрогеназа (цикл Кребса) |
| 4. | β-гидроксибутират-дегидрогеназа (β-окисление жирных кислот) |
| 5. | глутамат-дегидрогеназа (прямое и непрямое дезаминирование после трансаминирования) |
| 6. | алкоголь-дегидрогеназа (метаболизм этилового спирта) |
| 7. | глицерол-3-фосфат-дегидрогеназа (глицеролфосфатный NADH-переносящий челнок, глюконеогенез из глицерола, синтез глицерола) |
Задача 5. Повышенная экскреция двух основных аминокислот известна под названием «лизинурическая непереносимость белка», наследуется как аутосомный рецессивный признак. У гомозигот нарушен транспорт лизина, аргинина в кишечнике, реабсорбция в почках, захват этих веществ, клетками печени. В крови больных снижена концентрация лизина, аргинина и орнитина, в раннем возрасте у них отмечаются гепатоспленомегалия, непереносимость белка и эпизодическая интоксикация аммонием. Клинические проявления выхваны гипераммониемией. Для лечения этого заболевания используют цитруллин – нейтральную аминокислоту, всасывание в кишечнике и печеночный транспорт которой у больных не нарушены.
Почему у этих больных наблюдается гипераммониемия?
Для ответа:
а) напишите схему процесса, нарушение которого развивает гипераммониемию;
б) опишите токсическое действие аммиака;
в) объясните механизм лечебного действия цитруллина; какую диету, помимо лечения цитруллином, врач должен рекомендовать больному при такой патологии.
ОТВЕТ:
а) Гипераммониемия может развиваться из-за недостаточного количества аргинина и орнитина, необходимых для нормального функционирования орнитинового цикла.
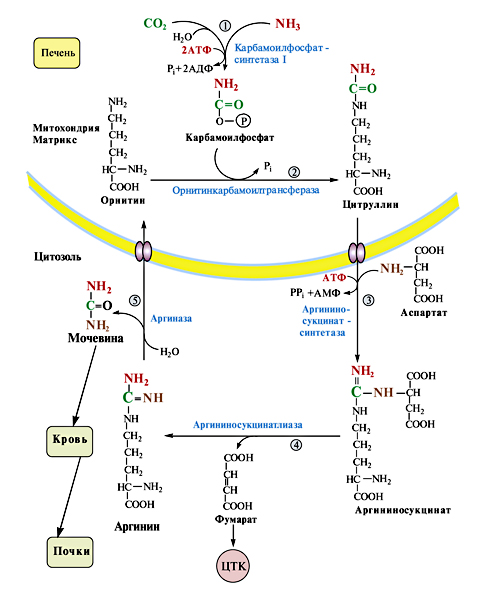
Рисунок 28. Орнитиновый цикл
б) ↓ V орнитинового цикла
↑ конц NН3 в клетках печени
NН3 выходит в кровь
NН3 проходит в любые клетки (также клетки мозга)
в клетках NН3 + Н+ → NН4+
↑ рН в клетках (алкалоз)
в клетках ↑ V реакций:
1) восстановительного аминирования 2) образование глутамина
α-кГ+NH3 + NADН+Н+ → Глу +NАD+ Глу + NН3 + АТФ → Глн
это приводит к:
↓ концентрации:
α -кГ, Глу, NН3
Это нарушает:
• функционирование Nа+,К+-АТФазы;
• энергетический обмен в клетках;
• обмен аминокислот;
• синтез ГАМК;
• выведение Глн и накопление его в клетках.
в) Метаболизм цитруллина обеспечивает процесс аргинином и орнитином, что снижает концентрацию аммиака в крови. На фоне перорального приема цитруллина необходимо ограничить количество белков в пище.
Задача 6. Исследованиями установлено, что накопление гомоцистеина – независимый фактор риска сердечно-сосудистых заболеваний – инфаркта миокарда, инсульта, венозной тромбоэмболии и атеросклероза. SH-группа гомоцистеина легко подвергается процессу перекисного окисления, что повреждает стенки сосудов. На поврежденную поверхность осаждаются «пенистые клетки», содержащие большое количество холестерола, начинают образовываться атеросклеротические бляшки. Кроме того, гомоцистеин тормозит работу противосвертывающей системы, что нарушает свертываемость крови. В норме содержание гомоцистеина в плазме крови составляет 5–15 мкмоль/л. При увеличении уровня гомоцистеина в плазме на 2,5 мкмоль/л риск инфаркта миокарда возрастает на 10%. Учитывая данные свойства гомоцистеина, его накопление в крови – одно из звеньев патогенеза ранней тромбоваскулярной болезни. При наличии ее увеличивается риск развития тромбозов, что в дальнейшем развивает инфаркты и инсульты.
Объясните особенности метаболизма гомоцистеина в организме и молекулярный механизм его последующего накопления в крови.
Для ответа:
а) напишите формулу гомоцистеина;
б) укажите, какую роль гомоцистеин играет в обмене других аминокислот; приведите формулы этих аминокислот;
в) нарисуйте схемы основных путей образования и катаболизма гомоцистеина;
г) назовите ферменты, которые участвуют в его утилизации, и коферменты;
д) изложите, дефицит каких витаминов – наиболее частая причина гипергомоцистеинемии.
ОТВЕТ:
а)
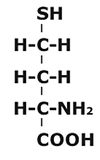
Рисунок 29. Гомоцистеин
б) Гомоцистеин – промежуточная аминокислота в обмене серосодержащих аминокислот. Он превращается в метионин под действием гомоцистеин-метилтрансферазы, таким образом непосредственно участвуя в регенерации метионина. Может использоваться для синтеза цистеина.
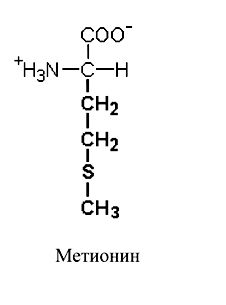
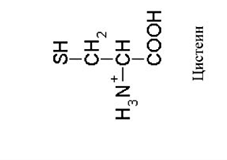
Рисунок 30. Метионин, Цистеин
в)
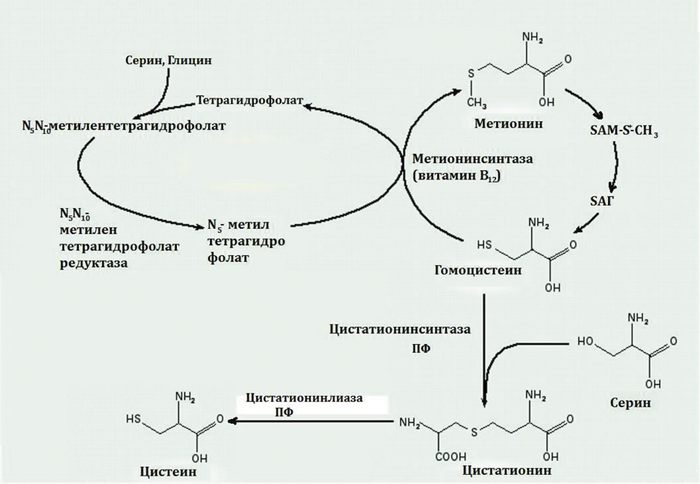
Рисунок 31. Синтез и распад гомоцистеина
г) Метионинсинтаза (гомоцистеин-метилтрансфераза), цистатионин-синтаза. Метилкобаламин, N5-метилтетрагидрофолат, пиридоксальфосфат.
д) Для того чтобы утилизировать гомоцистеин и предотвратить гипергомоцистеинемию, необходимо постоянное поступление с пищей фолиевой кислоты, поскольку ее производное метил-Н4-фолат участвует в реакции превращения гомоцистеина в метионин. В этой реакции метил-Н4-фолат передает метильную группу на кобаламин (витамин В12), метилкобаламин непосредственно участвует в регенерации метионина. Гомоцистеин также используется для синтеза цистеина. Реакции синтеза происходят при участии пиридоксальфосфата – кофермента витамина В6.
 2015-03-08
2015-03-08 7396
7396
