Ароматическими называются углеводороды, структура которых находится в соответствии с критериями ароматичности.
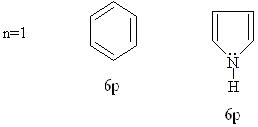
Критерии ароматичности (правило Хюкеля): к ароматическим относятся соединения, содержащие замкнутую циклическую систему делокализированных р-электронов, электронное облако которых содержит (4n+2) электрона. Структура бензола и пиррола полностью соответствует критериям ароматичности.
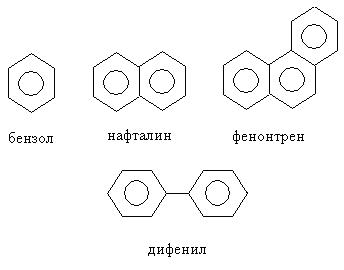
К ароматическим относятся также многоядерные ароматические соединения
и соединения, содержащие боковую цепь с одинарными и двойными связями:
Электронная структура молекулы бензола. В молекуле бензола атом углерода находится в состоянии sp2-гибридизации с валентным углом между δ-связями 120º. 6 р-электронов образуют делокализированную систему, стабилизированную резонансом. С точки зрения современных представлений молекула бензола представляет собой гибрид двух структур, вклад каждой из которых эквивалентен.
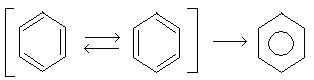
Бензол является плоской молекулой, р-электроны располагаются перпендикулярно плоскости молекулы бензольного кольца:
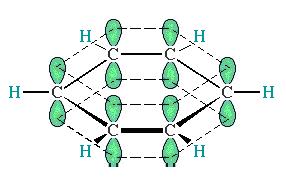
Делокализация р-электронов приводит к уменьшению длины σ-связи (0,139 нм).
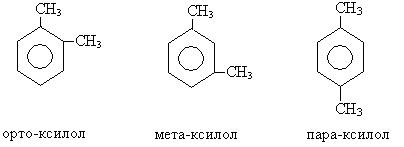
Номенклатура и изомерия. В ряду ароматических углеводородов сохраняется большее количество тривиальных названий (толуол, ксилол, кумол).
Для дизамещенных производных бензола в названии используются приставки «орто-», «мета-», «пара-».
По систематической номенклатуре все соединения рассматриваются как замещенные бензола. Для составления названия нумеруют бензольное кольцо с тем, чтобы заместители получили наименьшую цифру, и указывают положение заместителей.
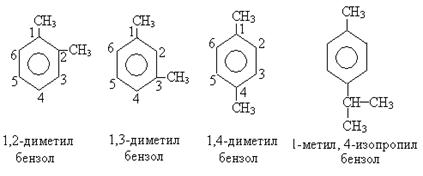
Изомерия в бензольном ряду начинается с дизамещенных производных и обусловлена как величиной и числом радикалов, так и их положением.
Cпособы получения. Существует несколькоспособов получения аренов.
1. Ароматические углеводороды в большом количестве содержатся в некоторых видах нефти.
2. Выделяют из каменноугольной смолы на коксохимических производствах.
3. Дегидроциклизация алканов (способ Казанского-Платэ):
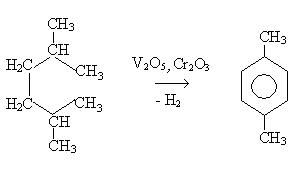
4. Дегидрирование циклоалканов:
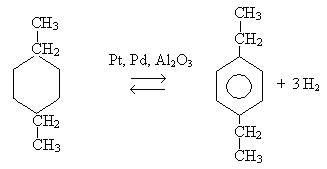
5. Реакция Вюрца – Фиттига:
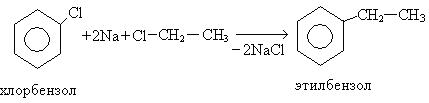
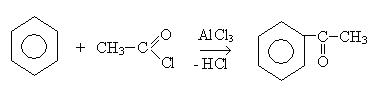
6. Реакция алкилирования (реакция Фридеря-Крафтса):
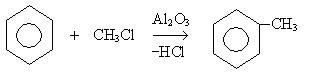
7. Восстановление ароматических кетонов:
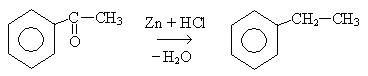
8. Сплавление солей ароматических карбоновых кислот со щелочами:
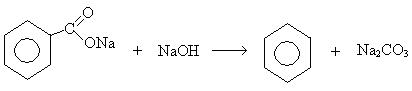
Химические свойства ароматических углеводородов. Tипичными реакциями ароматических углеводородов являются реакции электрофильного замещения (SE). К этим реакциям предрасполагает вся электронная структура бензола. Бензольное кольцо является носителем повышенной электронной плотности, поэтому в химических реакциях к бензольному кольцу будут стремиться электрофильные частицы. При этом наиболее доступными будут являться связи, расположенные по периферии молекулы, которые легко разрываются и обеспечивают протекание реакции замещения.
Кроме реакций электрофильного замещения в жестких условиях бензол способен вступать в реакции присоединения и окисления.
Реакции электрофильного замещения (SЕ).
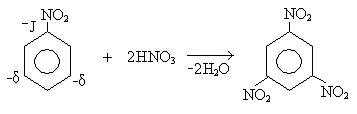
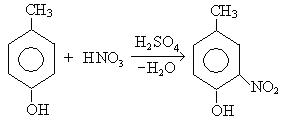
1. Реакция нитрования:
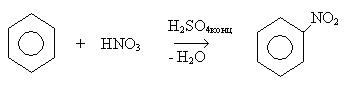
Механизм реакции:
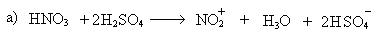
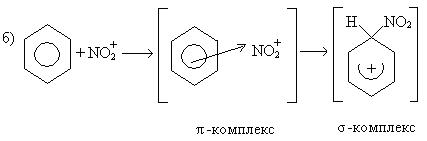
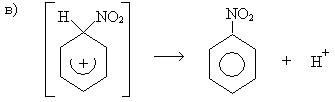
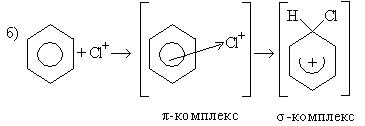
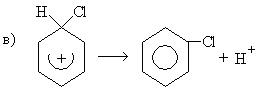
σ-комплекс — это промежуточная структура, лишенная ароматических свойств, которая в некоторых реакциях может быть выделена в свободном виде. Четыре р-электрона ароматической системы делокализованы в сфере действия только пяти углеродных атомов. Один из атомов углерода изменяет тип гибридизации с sp2 на sp3.
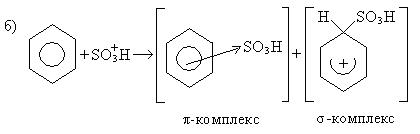
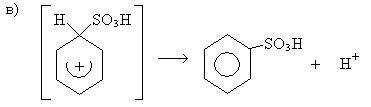
2. Реакции сульфирования:
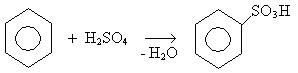
Механизм:
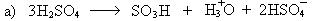
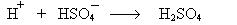
3. Реакция галоидирования:
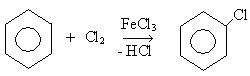
Механизм:
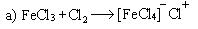
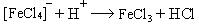
4. Реакция алкилирования:
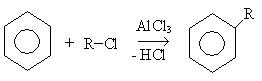
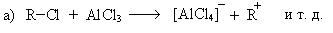
5. Реакции ацелирования:
Правила замещения в бензольном кольце. В молекуле бензола электронная плотность распределена равномерно, но если один из атомов водорода заместить на какой-либо радикал, то происходит перераспределение электронной плотности в бензольном кольце и появляются атомы углерода с большей или меньшей электронной плотностью. Заместители, присутствующие в бензольном кольце, могут быть двух типов:
― заместители первого рода;
― заместители второго рода.
К заместителям первого рода относятся атомы и группы атомов, способные увеличить электронную плотность на бензольном кольце (донорные заместители):
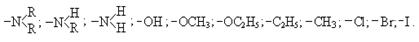
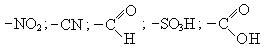
К заместителям второго рода относятся атомы и группы атомов, которые уменьшают электронную плотность на бензольном кольце (акцепторные заместители):
Совокупность закономерностей, определяющих порядок протекания реакций электрофильного замещения в бензольном кольце, называются правилами замещения в бензольном кольце:
— заместители первого рода активируют бензольное кольцо и ориентируют вступление новых заместителей в реакциях электрофильного замещения в орто- и пара-положение по отношению к имеющемуся в кольце заместителю:
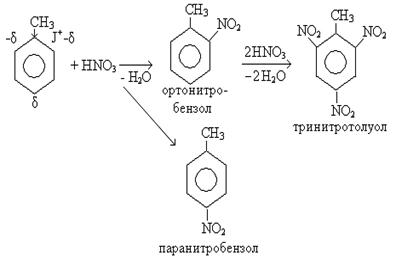
— заместители второго рода дезактивируют бензольное кольцо и ориентируют вступление новых заместителей в реакциях электрофильного замещения в мета-положение:
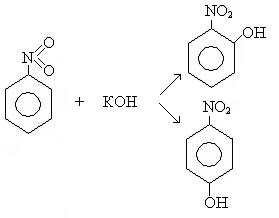
— реакции нуклеофильного замещения в бензольном кольце протекают с большим трудом. К ним относятся такие реакции, как аминирование (NaNH2) и гидроксилирование (КОН). Заместители второго рода в реакциях нуклеофильного замещения ориентируют вступление новых заместителей в орто- и пара- положение.
Если в бензольном кольце присутствуют два заместителя. то ориентировочно можно руководствоваться следующим правилом: влияние сильно активирующих заместителей
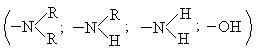
преобладает над влиянием слабоактивирующих заместителей
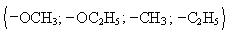
и слабодезактивирующих (─ Cl; ─ Br; ─ I), далее идут заместители второго рода. Новый заместитель не может становиться между имеющимися заместителми.
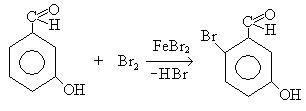
 2015-03-20
2015-03-20 4074
4074
