Цель работы: Определить удельную и молярную электропроводность, степень и константу диссоциации слабой кислоты.
:
I. Определение константы диссоииаиии слабой кислоты.
1. Промыть электрод с ячейкой дистиллированной водой и раствором уксусной кислоты концентрации 0,1 моль/л.
2.С помощью мерного цилиндра налить в стакан 50 ил раствора уксусной кислоты концентрации 0,1 моль/л.
3. Опустить электрод с ячейкой в стакан с уксусной кислотой и измерить удельную электропроводность раствора. Результаты измерений записать в табл.3.1.
4. Разбавить раствор в два раза, для этого отлить из стакана 25 мл раствора и добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,05 моль/л), тщательно перемешать раствор и дважды измерить его удельную электропроводность.
5. Отлить из стакана 25 мл раствора и добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,025 моль/л), тщательно перемешать раствор и дважды измерить его удельную электропроводность.
6. Отлить из стакана 25 мл раствора и добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,0125 моль/л), тщательно перемешать раствор и дважды измерить его удельную электропроводность.
7. Рассчитать значения:
V=1000/C,
λ=æ/C,
α=λ/ λ°
λ°= λ°(H+)+ λ° (CH3COO-),
K=C∙α2/(1-α).
Величину λ ° рассчитать, используя подвижности аниоов и катионов из справочных данных.
8.Результаты вычислений представить графически в виде зависимостей 1) удельной электропроводности от разведения, 2)молярной электропроводности от разведения и 3) степени диссоциации от разведения.
Таблица 3.1
Определение константы диссоциации слабой кислоты
Температура опыта.........................
| Cмоль/л | V=1/C См3/моль | Nизм | æ Ом-1∙см-1 | λ Ом-1∙см2∙моль-1 | α | Кд | 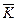 |
| 0,1 | |||||||
| 0,05 | |||||||
| 0,025 | |||||||
| 0,0125 |
Контрольные вопросы
Перед выполнением работы:
1. Каким образом выполняется порядок работы?
2. Как рассчитать удельную и молярную электропроводности раствора? Дайте определения и размерность этих величин.
3. Что называется степенью диссоциации?
4. Как рассчитать константу диссоциации слабого элетролита?
5. Рассчитать концентрацию раствора электролита, если его разведение 50000 см3∙моль-1.
К защите работы:
1. Приведите примеры сильных и слабых электролитов.
2. Поясните термины: электропроводность (удельная и молярная), электрическая подвижность ионов.
3. От каких факторов зависит электропроводность растворов электролитов?
4. Объясните полученные в работе зависимости удельной и молярной электропроводности слабого электролита от его концентрации.
5. Сформулируйте закон Кольрауша.
6. Рассчитайте удельную электрическую проводимость 0,16 М раствора пропионовой кислоты при 298 К, если Кд(C2H5COOH)=1,34∙10-5.
 2015-03-20
2015-03-20 1967
1967
