При наложении разности потенциалов к раствору, ионы находившиеся в непрерывном хаотическом тепловом движении, приобретают направленное движение от одного полюса к другому: катионы и анионы движутся в противоположных направлениях – возникает электрический ток. Так как растворы электролитов переносят электричество за счет движения ионов, их относят к проводникам второго рода.
Количественной характеристикой способности системы проводить электрический ток является электропроводность. Единицей электропроводности растворов электролитов служит удельная электропроводность 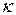 :
:
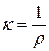 , [
, [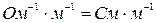 ]
]
где 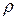 – удельное сопротивление:
– удельное сопротивление: 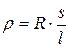 ;
;
где 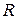 – общее сопротивление проводника,
– общее сопротивление проводника, 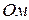 ;
;
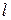 ,
, 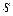 – длина,
– длина, 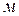 и поперечное сечение проводника,
и поперечное сечение проводника, 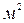 .
.
Удельная электропроводность – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами площадью по 1 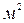 , расположенными на расстоянии 1
, расположенными на расстоянии 1  .
.
Удельная электропроводность зависит от
– концентрации электролита;
– вязкости и диэлектрической проницаемости растворителя;
– температуры;
– 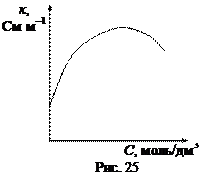 скорости движения ионов, которая определяется величиной заряда иона и его радиуса с учетом гидратации.
скорости движения ионов, которая определяется величиной заряда иона и его радиуса с учетом гидратации.
При увеличении концентрации электролита удельная электропроводность сначала увеличивается, а затем уменьшается (рис. 25). Такая зависимость характерна как для сильных, так и для слабых электролитов. В случае слабых электролитов падение удельной электропроводности в области высоких концентраций объясняют уменьшением степени диссоциации, а сильных – электростатическим взаимодействием между ионами в растворе.
Молярная электропроводность 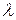 – это удельная электропроводность объема раствора электролита, содержащего 1
– это удельная электропроводность объема раствора электролита, содержащего 1 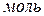 растворенного вещества:
растворенного вещества:
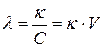 , [
, [ ], (183)
], (183)
где  – разведение (объем раствора, в котором содержится 1 моль электролита).
– разведение (объем раствора, в котором содержится 1 моль электролита).
Если молярная концентрация  выражена в
выражена в 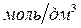 , то:
, то:
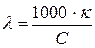 ; [
; [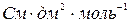 ].
].
где 1000 – коэффициент перевода концентрации из 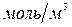 в
в 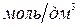 .
.
 С ростом разбавления (уменьшением концентрации) электролита молярная электропроводность возрастает, что объясняют уменьшением электростатического взаимодействия ионов (рис. 26). На рис. 26 кривая I соответствует сильному электролиту, кривая II – слабому. Каждая кривая отсекает на оси ординат отрезок, характеризующий предельную молярную электропроводность
С ростом разбавления (уменьшением концентрации) электролита молярная электропроводность возрастает, что объясняют уменьшением электростатического взаимодействия ионов (рис. 26). На рис. 26 кривая I соответствует сильному электролиту, кривая II – слабому. Каждая кривая отсекает на оси ординат отрезок, характеризующий предельную молярную электропроводность 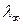 – т.е.
– т.е. 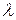 при бесконечном разбавлении раствора (при
при бесконечном разбавлении раствора (при 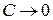 ).
).
С повышением температуры электропроводность растворов электролитов увеличивается. Это объясняют понижением вязкости раствора и, как следствие, увеличением скорости перемещения ионов, а для слабых электролитов еще и увеличением степени диссоциации.
В условиях предельного разбавления выполняется закон независимого движения ионов – закон Кольрауша, согласно которому предельная молярная электропроводность 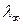 раствора электролита равна сумме молярных электропроводностей (подвижностей) катиона
раствора электролита равна сумме молярных электропроводностей (подвижностей) катиона 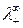 и аниона
и аниона 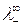 при бесконечном разбавлении:
при бесконечном разбавлении:
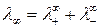 . (184)
. (184)
Предельные подвижности ионов определены экспериментально в стандартных условиях (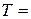 298
298 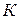 ,
, 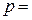 1
1 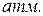 ) и приведены в справочной литературе.
) и приведены в справочной литературе.
Подвижность иона характеризует количество электричества, которое он переносит и определяется абсолютной скоростью его движения (или абсолютной подвижностью – т.е. скоростью движения при напряженности электрического поля 1 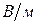 ).
).
Абсолютные скорости движения большинства ионов равны 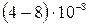
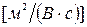 . Исключение составляют только ионы гидроксония
. Исключение составляют только ионы гидроксония 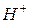 и гидроксил–ионы
и гидроксил–ионы 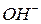 , для которых
, для которых 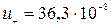 и
и 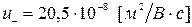 .
.
Так как абсолютные скорости движения катионов и анионов неодинаковы, то доля электричества, переносимого отдельными ионами может различаться. Для характеристики количества электричества, переносимого данным видом ионов применяют числа переноса. Число переноса – это отношение количества электричества 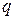 , перенесенного данным видом ионов к общему количеству электричества, перенесенного раствором электролита.
, перенесенного данным видом ионов к общему количеству электричества, перенесенного раствором электролита.
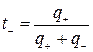 ;
; 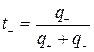 ,
,
где 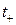 ,
, 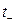 – числа переноса катионов и анионов, соответственно.
– числа переноса катионов и анионов, соответственно.
Числа переноса катионов 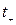 и анионов
и анионов 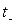 можно выразить через электропроводности:
можно выразить через электропроводности:
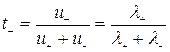 ;
; 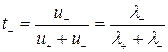 .
.
Таким образом, числа переноса ионов – есть относительные скорости их движения или их относительные подвижности.
Сумма чисел переноса катионов и анионов
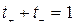 .
.
Числа переноса ионов электролитов определены и приведены в справочной литературе.
Поскольку большинство катионов и анионов (кроме 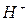 и
и 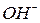 ) характеризуются сопоставимыми скоростями движения в растворах, то числа переноса ионов большинства бинарных электролитов не сильно отличаются от 0,5. Несмотря на различия в числах переноса катионов и анионов нарушения закона электронейтральности не происходит.
) характеризуются сопоставимыми скоростями движения в растворах, то числа переноса ионов большинства бинарных электролитов не сильно отличаются от 0,5. Несмотря на различия в числах переноса катионов и анионов нарушения закона электронейтральности не происходит.
Влияние межионного взаимодействия на электропроводность раствора отражает коэффициент электропроводности 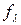 , зависящий от концентрации электролита, вязкости растворителя, температуры:
, зависящий от концентрации электролита, вязкости растворителя, температуры:
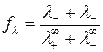 ,
,
А взаимосвязь 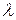 с
с 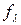 и степенью диссоциации
и степенью диссоциации 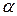 выражает уравнение:
выражает уравнение:
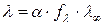 . (185)
. (185)
Для растворов слабых электролитов межионным взаимодействием можно пренебречь, тогда 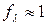 , тогда
, тогда
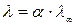 .
.
Откуда следует, что
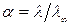 . (186)
. (186)
Уравнение Аррениуса (186) лежит в основе экспериментального метода определения степени и константы диссоциации слабого электролита по электропроводности раствора. Экспериментально определив 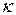 для раствора известной концентрации, рассчитывают
для раствора известной концентрации, рассчитывают 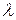 . На основе справочных данных по уравнению Кольрауша вычисляют
. На основе справочных данных по уравнению Кольрауша вычисляют 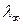 , затем
, затем 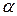 по уравнению (186) и константу диссоциации
по уравнению (186) и константу диссоциации 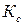 по уравнению Оствальда (181).
по уравнению Оствальда (181).
Из закона разбавления Оствальда (181) и уравнения Аррениуса (186), получим:
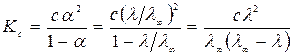 . (187)
. (187)
Для сильных электролитов 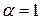 , тогда из (185) получим
, тогда из (185) получим
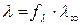 .
.
Следовательно, 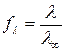 . (188)
. (188)
 2014-02-12
2014-02-12 11161
11161
