Значительно большей скоростью движения в водной среде, по сравнению с другими ионами, обладают ионы Н+ и ОН–. Это связано с тем, что механизм перемещения данных ионов отличается от механизма перемещения других ионов.
Удельная электропроводность растворов зависит также от индивидуальных свойств ионов: величины их заряда, радиуса, степени гидратации, скорости движения во внешнем электрическом поле.
Рис. 81. Зависимость удельной электропроводности растворов от их концентрации
Удельная электропроводность характеризует электропроводность объема раствора, заключенного между двумя параллельными электродами, имеющими площадь поверхности 1 м2 каждый и расположенными на расстоянии 1 м друг от друга.
Удельная электропроводность растворов в системе СИ измеряется в См ∙ м–1 или в Ом–1 ∙ м–1.
Удельная электропроводность чистой дистиллированной воды при 291 K равна 5 ∙ 10–9 См ∙ м–1. Т.е., если мы опустим в эту воду два электрода площадью 1 м2 каждый, то при расстоянии между ними 1 м и разности потенциалов в 1 В сила тока будет равна 5 ∙ 10–9 А. Такое маленькое значение удельной электропроводности воды объясняется слабой диссоциацией ее молекул
Н2О «Н+ + ОН–
и низкой концентрацией положительно (Н+) и отрицательно
(ОН–) заряженных ионов.
Удельная электропроводность растворов электролитов значительно выше и зависит от общего числа ионов в единице их объема, а значит и от концентрации самого электролита (табл. 18) и его степени диссоциации (если электролит слабый).
Таблица 18. Удельная электропроводность растворов некоторых электролитов в зависимости от их концентрации при 291 K, См ∙ м–1
| Концентрация раствора, % | KCl | NaOH | H2SO4 | NaCl |
| 6,9 | 13,0 | 21,0 | 6,7 | |
| 14,0 | 19,0 | 39,0 | 12,0 | |
| 20,0 | – | 54,0 | 16,0 |
Причем с увеличением концентрации как сильных, так и слабых электролитов удельная электропроводность раствора увеличивается до некоторого определенного предела, а затем уменьшается (рис. 81).
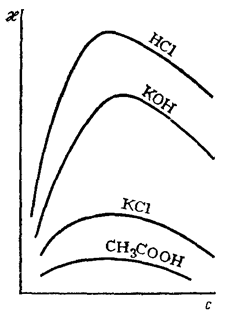
В разбавленных растворах сильных электролитов первоначальный рост электрической проводимости с повышением их концентрации обусловлен увеличением числа ионов. Однако в области концентрированных растворов одновременно с ростом количества ионов увеличиваются и силы электростатического притяжения между ними, интенсифицируется процесс образования ионных атмосфер и ассоциатов (ионных двойников, тройников и т.д.), и как следствие, уменьшается скорость движения ионов во внешнем электрическом поле. Все эти факторы и приводят в конечном итоге к снижению электропроводности.
В растворах слабых электролитов (как разбавленных, так и концентрированных) силы электростатического взаимодействия между ионами являются незначительными из-за малой концентрации последних и большого расстояния между ними. Поэтому они не оказывают существенного влияния на электропроводность. Но при повышении концентрации вещества до определенных пределов происходит уменьшение степени диссоциации электролита и, соответственно, концентрации самих ионов.
Удельная электропроводность растворов электролитов (в отличие от металлов) возрастает с повышением температуры (табл. 19). Причин, вызывающих данное явление, может быть несколько.
Таблица 19. Зависимость удельной электропроводности 0,1 М раствора KCl от температуры
| T, K | ϰ ∙ 10–1, См ∙ м–1 |
| 7,13 | |
| 9,32 | |
| 10,66 | |
| 14,10 |
Во-первых, это связано с увеличением скорости движения самих ионов из-за уменьшения вязкости среды; во-вторых, с возрастанием степени диссоциации слабых электролитов.
Опытным путем было установлено, что повышение температуры на 1о ведет к возрастанию проводимости раствора на 1,5-2,7% (в зависимости от его концентрации и вида содержащегося в нем электролита).
В таблице 20 приведены значения абсолютной скорости движения некоторых ионов к соответствующему электроду при приложенной разности потенциалов 1 В/м.
Таблица 20. Абсолютные скорости движения ионов (м/с) в воде при Т = 291 K
| Катионы | Скорость ∙ 10–6, м/с | Анионы | Скорость ∙ 10–6, м/с |
| H+ | 32,7 | OH– | 18,7 |
| Li+ | 3,5 | Cl– | 6,85 |
| Na+ | 4,6 | NO3– | 6,40 |
| K+ | 6,75 | I– | 6,95 |
| NH4+ | 6,70 | MnO4– | 5,60 |
Как видно из таблицы 20, скорости перемещения ионов при прохождении через раствор электрического тока достаточно малы по сравнению со скоростями движения молекул в газообразных средах и электронов в металлических проводниках (различаются более чем в миллион раз). Соответственно, и удельная электропроводность растворов примерно во столько же раз меньше по сравнению с металлическими проводниками.
Низкая подвижность ионов в водных растворах объясняется тем, что они окружены гидратными оболочками и при движении испытывают существенное сопротивление со стороны растворителя.
В водных растворах ион водорода находится в виде иона гидроксония Н3О+. В электрическом поле Н+ переходит от иона гидроксония к ближайшей молекуле Н2О. Вновь образовавшийся ион Н3О+ передает свой протон следующей молекуле Н2О (рис. 82а). Аналогично перемещается протон от молекулы воды к гидроксид-иону (рис. 82б).
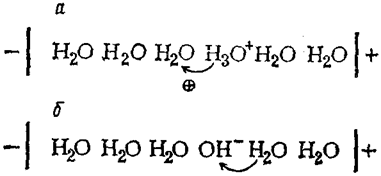
Рис. 82. Схема механизма электропроводимости ионов Н+ (а) и ОН– (б)
В обоих случаях перенос электрического заряда осуществляется не за счет движения самих ионов, а в результате перескока протона от одной частицы к другой. Поскольку протон в молекуле воды связан прочнее, чем в Н3О+, то скорость перемещения гидроксид-иона почти в 2 раза меньше, чем катиона водорода. Такой способ перемещения ионов называется иначе «эстафетным».
Таким образом, на удельную электропроводность растворов оказывают влияние достаточно много самых различных факторов, рассмотренных нами выше. На основе ее определения сложно сделать какие-то обобщающие выводы при сравнивании свойств растворов разных веществ.
В связи с этим ввели понятие об эквивалентной электропроводности.
 2014-02-09
2014-02-09 2192
2192
