Зависимость удельной электропроводности от концентрации и температуры
Покажем рисунком зависимость удельной электропроводности растворов некоторых электролитов от концентрации.
Из рис. видно, что во всех случаях кривые зависимости c=f(c) имеют ярко выраженный максимум наличие которого можно объяснить следующем образом. В разбавленных растворах электролитов скорость движения ионов почти не зависит от концентрации (почти нет взаимного влияния ионов) и электропроводность растет почти прямо пропорционально концентрации.. В концентрированных растворах ионная атмосфера существенно уплотняется и взаимное влияние ионов уменьшает скорость их движения и электропроводность падает. Количественно уменьшение скорости движения ионов в растворе с увеличением концентрации характеризуется для
· сильных электролитов – уменьшением коэффициентов активности f±;
· слабых электролитов – уменьшением степени диссоциации aэ.
С увеличением концентрации значение f± уменьшается или уменьшение aэ становится преобладающим и c уменьшается. С ростом температуры раствора c растет, т.к. уменьшаются гидратные оболочки ионов и вязкость раствора, а с ростом давления (Р>1000 бар) c уменьшается.
Отсутствие однозначной зависимости удельной электропроводности от концентрации растворов заставило ввести понятие эквивалентной электропроводности (l), представляющее собой отношение удельной электропроводности к числу грамм-эквивалентов растворенного вещества в 1см3 раствора, т.е.
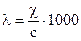 , Ом-1см2г-экв-1,
, Ом-1см2г-экв-1,
где с – нормальная концентрация растворов, г-экв/дм3.
Или в виде:
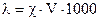 , Ом-1см2г-экв-1,
, Ом-1см2г-экв-1,
где V – объем раствора в мл, в котором растворен 1 г-экв электролита.
V=1/с и называется разбавлением раствора. (В системе СИ l выражается в Ом-1см2г-экв-1. Для перевода значений l выражающихся в Ом-1см2г-экв-1 в системе Си, значения l надо умножить на 10-4).
Т.к. с ростом концентрации c увеличивается медленнее, чем концентрация (можно видеть из приведенного выше рисунка), то с увеличением концентрации l уменьшается. И наоборот, с уменьшением концентрации раствора электролита эквивалентная электропроводность его возрастает, достигая некоторого предельного значения, соответствующего бесконечному разбавлению (с=0). Такое предельное значение эквивалентной электропроводности принято называть эквивалентной электропроводностью при бесконечном разведении (l0). (По физическому смыслу величина l0 представляет собой электропроводность бесконечно большого объема раствора, содержащего 1 г-экв растворенного вещества, причем электроды бесконечно большой площади находятся на расстоянии 1 см друг от друга).
Покажем рисунком зависимость эквивалентной электропроводности от концентрации для разных электролитов: l=f(Öс). Из рисунка видно, что для сильных электролитов, степень диссоциации a которых равна 1 (aс.э.=1) – НСl, КОН, NаСl, LiCl – наблюдается медленное линейное уменьшение l с увеличением концентрации. Для слабых электролитов (СН3СООН) закон изменения l несколько иной.
Кроме этого, из приведенного рисунка видно, что значения эквивалентных электропроводностей при бесконечном разведении (l0) для разных электролитов различны. Это связано с тем, что способность растворов электролитов переносить электрический ток определяется не только зарядом ионов и их количеством в растворе, но и истинными скоростями движения ионов в растворе.
Подвижность ионов (абсолютная подвижность, предельная подвижность)
Различия в величинах эквивалентных электропроводностей электролитов при бесконечном разведении объясняются различием в скоростях движения разных ионов. Т.к. движения заряженных частиц в растворе обусловлено (вызвано) приложенным напряжением (созданием разности потенциалов в растворе), то скорость движения ионов пропорциональна падению потенциала на длине в 1 см (градиенту потенциала).
Скорость движения ионов в растворе при градиенте потенциала, равном 1 (1 в/см), называются абсолютными подвижностями ионов.
Если обозначить абсолютные подвижности ионов через U+ и U-, то эквивалентную электропроводность раствора данного электролита можно выразить как
l=К¢×(U++U-)
где К¢ - коэффициент пропорциональности, независящий от вида электролита. Можно показать, что коэффициент пропорциональности К¢ есть не что иное, как число Фарадея F=96500 кул., а эквивалентная электропроводность выражается в виде:
l=F(U++U-) или
l=l++l-, где l+=F×U+,
l-=F×U-
Величины l+ и l- носят название подвижностей ионов. Подвижности ионов равны эквивалентным электропроводностям ионов – катионов и анионов в отдельности и измеряются в тех же единицах: Ом-1см2г-экв-1.
То есть эквивалентная электропроводность раствора электролита есть величина аддитивная, которая складывается из эквивалентных электропроводностей отдельных ионов. Значение предельной подвижности иона (l0,i) для данного иона есть величина постоянная при данной температуре
(l0,i)Т=const=const
С ростом концентрации электролита подвижность ионов данного вида уменьшается, что ведет к уменьшению и эквивалентной электропроводности раствора (что видно и из рисунка 2). Значение эквивалентной электропроводности раствора электролита в зависимости от эквивалентной электропроводности при бесконечном разведении может быть выражена эмпирической формулой Кольрауша:
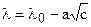 ,
,
где а – эмпирическая константа определенная для сильно разбавленных растворов.
Составляя уравнения 5 4, можно показать, что:
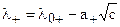
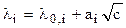

Таким образом, пользуясь величинами концентрации раствора (с) и подвижностью ионов в нем (li) можно вычислить значение предельной подвижности данного иона
Покажем таблицей значения предельных подвижностей некоторых ионов в водных растворах при 25оС.
| Катион | lо+, Ом-1см2г-экв-1 | Анион | lо, Ом-1см2г-экв-1 |
| H3O | 349,8 | OH- | 197,6 |
| Li+ | 38,6 | Cl- | 76,4 |
| Na+ | 50,1 | HCO3- | 44,5 |
| 1/2Мg2+ | 53,0 | 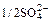 | 80,0 |
| 1/2Са2+ | 59,0 | 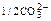 | 69,1 |
Из таблицы следует, что предельные подвижности всех ионов, кроме гидроксония и гидраксила, представляют собой примерно одинаковые величины. Объясняется это так.
В бесконечно разбавленном водном растворе электролита перемещаются гидратированные ионы, лишенные ионной атмосферы. Скорость движения таких ионов под действием разности потенциалов обратно пропорционально величине радиуса гидратированного иона. Очевидно, что скорость движения Li+ будет меньше, чем скорость движения Na+, а скорость движения Mg2+ меньше, чем скорость движения Са2+:
VLi+ < VNa+;
VMg2+<VCa2+
Т.к. величина радиусов гидратированных ионов лития больше, чем ионов Na+:
 а
а
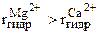
В то же время разница в величинах радиусов гидратированных ионов у равновалентных ионов незначительна, следовательно, и значение их предельных подвижностей не должны сильно различаться. Кроме того, скорости движения многовалентных ионов не должны быть значительно больше скоростей движения одновалентных, т.к. с увеличением валентности увеличивается и радиус гидратированных ионов.
Аномально больше величины предельных подвижностей ионов гидроксония и гидроксила могут быть объяснены следующим образом.
Ион гидроксония в растворе образуется в результате гидратации протона:
Н++Н2О®Н3О+.
Т.к. молекул воды много и все они обладают равной способностью гидратировать протон Н+, то на самом деле в воде происходит непрерывный обмен протоном между молекулами воды:
Н3О++Н2О®Н3О+.
В отсутствии направленного электрического поля такой обмен идет хаотически, а при наложении разности потенциалов, принимает направленное движение. При этом протон движется к катоду, перескакивая с одной молекулы воды на другую.
Поскольку разница протона очень мала движение его не стеснено молекулами воды, подвижность протона намного больше подвижности других ионов.
Аналогично можно объяснить высокую подвижность ионов гидроксила. Молекулы воды диссоциируют по уравнению Н2О«Н++ОН- в соответствии с Кw. При этом ион гидроксила может забирать протон у соседних молекул воды:
ОН-+Н2О®Н2О+ОН-.
При наложении разности потенциалов этот процесс имеет направленный (к аноду) характер и создается видимость движения ионов гидроксила к аноду. На самом деле движутся опять-таки протоны, что вызывает высокую предельную подвижность ионов гидроксила (условную), но в этом случае подвижность ОН- меньше, чем в чистом случае Н+, т.к. связь при молекуле воды сильнее, чем в ионе Н3О+.
Электропроводность сильных и слабых электролитов в зависимости от концентрации
Обратимся к причине, обуславливающей уменьшение l сильных и слабых электролитов при увеличении концентрации раствора. Мы уже говорили, что для сильных электролитов с увеличением концентрации уменьшается средний мольный фактор активности, а для слабых с увеличением концентрации уменьшается степень диссоциации электролита.
Уменьшение l сильного электролита с увеличением концентрации вызывается только уменьшением скорости движения ионов. При постоянном градиенте внешнего поля эта скорость зависит от таких тормозящих эффектов, как эффект релаксации ионной атмосферы, Электрофоретический эффект и силы трения. Эффект релаксации: каждый данный ион в растворе окружен ионной атмосферой. При перемещении его под действием внешнего электрического поля ион частично выходит из окружения (ионной атмосферы), но оно создается в новом положении центрального иона, а старая, дальняя часть ионной атмосферы рассеивается под действием осмотических сил. Время, в течении которого происходит восстановление ионной атмосферы на новом месте называется временем релаксации. Это время конечно (не бесконечно мало), поэтому движение центрального иона тормозится, т.к. «старая» ионная атмосфера препятствует движению центрального иона.
Электрофоретический эффект заключается в том, что под действием электрического поля ионы, составляющие ионную атмосферу сами движутся в сторону, противоположную движению центрального иона, что тормозит его движение. Силы трения определяются вязкостью среды.
Слабые электролиты:
Зависимость l от концентрации раствора для слабых электролитов может быть найдена опытным путем. Так для одновалентного электролита (NH4OH):
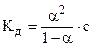 .
.
Известно, что l/l0=a/a0, т.к. a0=1, то a=l/l0
Подставляя значение a в уравнение Кд, получим:
 .
.
Это уравнение носит название закона разведения Оствальда и дает возможность связать Кд непосредственно с l.
 2014-02-04
2014-02-04 1477
1477








