601. Осмотическое давление 0,05 М раствора электролита равно 2,725 × 105 Па при 0 °С. Кажущаяся степень диссоциации электролита в растворе 70 %. На сколько ионов диссоциирует молекула электролита?
Ответ: на три иона.
602.Давление водяного пара над раствором, содержащим 24,8 г КСl в 100 г Н2О при температуре 100 °C, равно 9,14 ×
× 104 Па. Вычислите изотонический коэффициент, если давление водяного пара при этой температуре равно 1,0133 · 105 Па.
Ответ: 1,64.
603. Вычислите кажущуюся степень диссоциации хлорида калия в растворе, содержащем 4,47 г КСl в 100 г воды, если этот раствор замерзает при температуре –2 °C.
Ответ: 0,79.
604. Осмотическое давление 0,03 М водного раствора СаCl2 составляет 135 · 103 Па при температуре 0 °C. Вычислите кажущуюся степень диссоциации соли.
Ответ: 0,49.
605. Сильным или слабым электролитом является уксусная кислота, если раствор, содержащий 0,571 г кислоты в 100 г воды, замерзает при температуре –0,181 °C? Ответ объясните.
Ответ: является слабым электролитом, так как a = 2,2 %.
606. Раствор 1,7 г хлорида цинка в 250 г воды замерзает при температуре –0,24 °C. Вычислите кажущуюся степень диссоциации соли в этом растворе.
Ответ: 0,79.
607. Водный раствор соляной кислоты с моляльной концентрацией 0,5 моль/кг замерзает при температуре –1,83 °C. Вычислите кажущуюся степень диссоциации кислоты.
Ответ: 0,97.
608. В 0,1 л раствора содержится 0,62 г CuSO4 при температуре 19 °C. Осмотическое давление этого раствора при данной температуре равно 162·103 Па. Вычислите кажущуюся степень диссоциации соли.
Ответ: 0,72.
609. Водный раствор 5,95 г бромида калия в 500 г воды замерзает при температуре –0,338 °С. Вычислите кажущуюся степень диссоциации соли.
Ответ: 0,82.
610. Рассчитайте кажущуюся степень электролитической диссоциации хлорида лития в 0,1 н растворе соли, если раствор изотоничен с 0,19 М раствором сахара при температуре 0 °С.
Ответ: 0,2.
611.Давление пара водного раствора нитрата натрия (ω =
= 8 % мас.) равно 2268,8 Па при 20 °С. Давление паров воды при этой температуре равно 2337,8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
Ответ: 0,6.
612. Раствор, содержащий 0,05 моль сульфата алюминия в 100 г воды, замерзает при –4,19 °С. Определите изотонический коэффициент, если криоскопическая постоянная воды равна 1,86 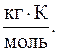
Ответ: 4,5.
613. Температура затвердевания чистого бензола равна 5,5 °С, а температура замерзания раствора 1,632 г трихлоруксусной кислоты в 100 г бензола равна 5,15 °С. Подвергаются ли молекулы трихлоруксусной кислоты диссоциации или ассоциации в растворе? Ответ объясните.
Ответ: молекулы подвергаются ассоциации, так как i < 1.
614. При растворении в 500 г воды 0,05 моль некоторого вещества температура замерзания раствора понижается на 0,3 °С. Является ли растворенное вещество электролитом?
Ответ: является электролитом, так как i > 1.
615. Температура кипения растворов определяется их концентрацией и определяет технологический режим упаривания в гидрометаллургии. Вычислите температуру кипения раствора, содержащего в 200 г воды 5,34 г NH4Cl, если степень диссоциации соли равна 80 %.
Ответ: 101,67 °С.
616. Растворы некоторых солей используют в холодильной технике как хладоагенты. Вычислите температуру замерзания такого раствора, который приготовлен из 500 мл воды и 3,55 г сульфата натрия. Степень диссоциации соли принять равной 70 %.
Ответ: –0,223 °С.
617. Электропроводимость электролитов – важнейший технологический показатель для электрохимических процессов – определяется степенью диссоциации веществ, находящихся в растворе. Определите степень диссоциации хлорида цинка, если раствор, содержащий 125 г воды и 0,85 г ZnCl2, замерзает при температуре –0,23 °С.
Ответ: 75,5 %.
618. Определите величину изотонического коэффициента для 0,15 М раствора электролиза, зная, что 1 л этого раствора содержит 2,21×1023 частиц (молекул и ионов) растворенного вещества.
Ответ: 2,24.
619. Степень диссоциации сульфата кадмия в 0,1 н растворе равна 0,4. Чему равно осмотическое давление раствора при 25 °С?
Ответ: 1,22 атм.
620. Осмотическое давление 0,01 н раствора хлорида калия при 0 °С равно 0,44 атм. Определите кажущуюся степень диссоциации электролита.
Ответ: 0,96.
621. Вычислите ионную силу, коэффициент активности иона Са2+ и его активность в растворе, 1 л которого содержит 0,002 моль СаСl2 и 0,003 моль Ca(NO3)2.
Ответ: I = 7 · 10-3; γ = 0,6; α = 3,6 ·10-6.
622. Вычислите активную концентрацию 0,005 М раствора Al2(SO4)3. Коэффициенты активности ионов Al3+ и SO42- равны, соответственно, 0,285 и 0,495.
Ответ: 4,24 ·10-24.
623. Вычислите концентрацию ионов водорода и степень диссоциации 0,5 н раствора уксусной кислоты (К д = 1,8 · 10-5).
Ответ: α = 0,006; [H+] = 0,003.
624. Рассчитайте ионную силу и активность ионов в растворе, содержащем 0,01 моль/л сульфата магния и 0,01 моль/л хлорида магния.
Ответ: I = 7 · 10-2; а (Mg2+) = 0,006 моль/л; а (SO 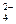 ) = = 0,003 моль/л; а (Cl-) = 0,0148 моль/л.
) = = 0,003 моль/л; а (Cl-) = 0,0148 моль/л.
625. Диссоциация угольной кислоты по первой ступени идет по схеме:
Н2СО3 ↔ Н+ + НСО 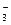 .
.
Концентрация ионов водорода в 0,005 М растворе равна 4,25 · 10-5 моль/л. Определите константу диссоциации.
Ответ: 3,61 ·10-7.
626. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,23 ·10-2. Рассчитайте константу диссоциации кислоты.
Ответ: К д = 1,74 · 10-5.
627. Вычислите ионную силу раствора, содержащего 0,373 г KCl и 2,116 г Sr (NO3)2 в 250 г Н2О.
Ответ: 0,141.
628. Вычислите ионную силу раствора «Трисоль», применяемого в медицинской практике, на основании его прописи: натрия хлорид – 0,5 г, калия хлорид – 0,1 г, натрия гидрокарбонат – 0,4 г, вода для инъекций – до 100 мл.
Ответ: 0,146 моль/л.
629. Вычислите активные концентрации ионов Zn2+ и SO 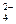
в промывных водах цинкового производства, содержащих 1,2 г/дм3 цинка.
Ответ: 0,005 моль/л.
630. Вычислите активные концентрации ионов Cd2+ и SO 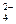 в промывных водах кадмиевого производства, содержащих 2,0 г/дм3 кадмия.
в промывных водах кадмиевого производства, содержащих 2,0 г/дм3 кадмия.
Ответ: 0,0051 моль/л.
631. Вычислите активную концентрацию ионов Fe2+ в растворе после травления металла, содержащего 0,05 моль/дм3 FeSO4 и 0,01 моль/л CoSO4.
Ответ: 0,018 моль/л.
632. Вычислите ионную силу раствора, содержащего 0,89 г нитрата натрия и 8,1 г сульфата меди в 250 г воды.
Ответ: 0,854.
633. В 1 л 0,01 М раствора уксусной кислоты содержится 6,26 ·1021 её молекул и ионов. Рассчитайте степень диссоциации уксусной кислоты.
Ответ: α = 0,04.
634. Определите степень диссоциации муравьиной кислоты в 0,01 н растворе, если в 1 мл раствора содержится 6,82 ·1018 растворенных частиц.
Ответ: α = 13,3 %.
635. Вычислите степень диссоциации сероводородной кислоты по первой ступени в 0,1 М растворе, если константа диссоциации кислоты для этой ступени равна 1,1 ·10-7 .
Ответ: α = 0,105 %.
636. Рассчитайте концентрацию азотистой кислоты в растворе с рН = 2,7.
Ответ: 0,01 М.
637. Рассчитайте молярность раствора щелочи MeOH, если значение рН = 11,87.
Ответ: 7,4 ·10-3 М.
638. Как изменится рН 0,5 М раствора гидроксида аммония при разбавлении его в 5 раз? Ответ подтвердите расчетами.
Ответ: рН = 13.
639. Определите рН раствора, в 1 дм3 которого содержится 2 г гидроксида натрия. Щелочь в растворе диссоциирует полностью.
Ответ: рН = 12,7.
640. Рассчитайте рН в 5 %-ном растворе муравьиной кислоты, если степень ее диссоциации составляет 0,01 %, а плотность раствора равна 1,012 г/мл.
Ответ: рН = 3,96.
641.Смешали 250 мл 1,4 М раствора NaOH и 650 мл 1,6 М раствора NaOH. Вычислите рН полученного раствора.
Ответ: рН = 13,57.
642. Вычислите рН раствора соляной кислоты, в котором концентрация HCl равна 4 · 10-4 моль/л, если коэффициент активности γ = 1.
Ответ: рН = 3,4.
643. Среднее значение рН морской воды равно 8,2. Вычислите концентрацию ионов гидроксония в г/л.
Ответ: 1,14 ·10-7 г/л.
644. Водный раствор сульфата меди (II) с массовой долей 1 % мас. (ρ = 1,009 г/см3) назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе.
Ответ: а (Cu2+) = 0,006 моль/л.
645. В желудочном соке содержится соляная кислота, которая относится к сильным электролитам и практически полностью диссоциирует в водных растворах. Рассчитайте рН желудочного сока, если массовая доля HCl в нем составляет в норме 0,05 %. Плотность желудочного сока принять равной 1 г/см3.
Ответ: рН = 1,86.
646. Рассчитайте концентрацию ионов водорода в артериальной крови с рН = 7,42.
Ответ: [H+] = 3,8 ·10-8 моль/л.
647. Растворили 5,6 г КОН в воде объёмом 1 л. 1 мл полученного раствора перенесли в воду объёмом 1 л. Определите рН и рОН полученного раствора.
Ответ: рН = 10; рОН = 4.
648. Определите концентрации ионов Н+ и ОН- в некотором растворе, если при 295 К его рН = 4,6.
Ответ: [H+] = 2,5 ·10-5 ; [ОH-] = 3,98 ·10-10.
649. Как изменится рН 0,03 М раствора щавелевой кислоты при разбавлении его в 10 раз?
Ответ: рН = 2,52.
650. Кислые сточные воды после травления изделий из стали последовательно нейтрализуют известковым молоком до рН:
а) 5,6; б) 6,5; в) 8,3. Вычислите активность ионов Н+ при указанных значениях рН.
Ответ: 2,51 ·10-6; 3,16 ·10-7; 5,01 ·10-9.
651. Промывные воды после травления, фосфатирования и химического полирования металлов содержат фосфорную, хлорную, уксусную кислоты. 120 мл 10 %-ной Н3РО4 (плотность
1,05 г/см3) разбавили водой до 2,5 м3. Чему равно рН разбавленного раствора?
Ответ: рН = 2,52.
652. Определите рН при сливании двух растворов: 25 мл 0,2 н раствора HCl и 25 мл 0,1 н раствора NaOH.
Ответ: рН = 1,3.
653.Произведение растворимости PbCl2 равно 1,7 · 10-5. Чему равна концентрация ионов свинца в насыщенном растворе PbCl2?
Ответ: 1,6 ·10-2.
654. Произведение растворимости CaSO4 равно 6 ·10-5. Выпадет ли осадок CaSO4, если смешать равные объемы 0,2 н растворов CaCl2 и Na2SO4? Степень диссоциации этих электролитов принять равной единице.
Ответ: осадок образуется.
655. Насыщенный при комнатной температуре раствор PbSO4 объемом 3 дм3 содержит 0,132 г соли. Вычислите ПР(PbSO4).
Ответ: 2,1 ·10-8.
656. Выпадет ли осадок Ag2CrO4 при сливании 0,5 л раствора, содержащего 0,1 моль/дм3 Ag+, и 0,5 л раствора, содержащего 0,01 моль/дм3 CrO42-, если ПР(Ag2CrO4) = 1,1 · 10-12?
Ответ: осадок образуется.
657. Рассчитайте растворимость фторида кальция в воде, если его произведение растворимости составляет 4 · 10-11.
Ответ: 2,15 ·10-4 моль/л.
658. Выпадет ли осадок йодида свинца (II) при температуре 25 °C после сливания 100 см3 0,005 М раствора нитрата свинца (II) и 200 мл 0,01 М раствора йодида калия, если ПР(PbI2) = 8,7 × × 10-9?
Ответ: осадок образуется.
659. Выпадет ли осадок при смешивании 200 мл раствора с концентрацией сульфата цинка 0,02 моль/л с 600 мл раствора с концентрацией сульфида натрия 0,008 моль/л? Ответ подтвердите расчетом.
Ответ: осадок образуется.
660. С помощью расчетов докажите, что осадок не образуется при смешивании насыщенного раствора сульфата кальция с равным объёмом раствора с концентрацией хлорида стронция, равной 0,00001 моль/л.
661. Рассчитайте равновесную молярную концентрацию (моль/л) анионов в насыщенном растворе карбоната серебра (I) при температуре 25 °C, если ПР = 8,7 · 10-12.
Ответ: 2,5 ·10-5 моль/л.
662. Рассчитайте значение ПР гидроксида металла Ме(ОН)2, если рН его насыщенного раствора равен 9,54 при температуре 25 °C.
Ответ: 1,67 · 10- 13.
663. Выпадет ли осадок после сливания равных объёмов 0,0023 М растворов нитрата серебра и бромида калия при температуре 25 °C, если ПР(AgBr) = 6,3 · 10-13?
Ответ: осадок образуется.
664. Выпадет ли осадок после сливания 5 мл 0,004 М хлорида кадмия и 15 мл 0,003 М раствора гидроксида натрия при 25 °C, если ПР(Сd(ОН)2) = 2 · 10-14?
Ответ: осадок образуется.
665. Насыщенный раствор AgIO3 объёмом 3 дм3 содержит в виде ионов 0,176 г серебра. Вычислите произведение растворимости AgIO3.
Ответ: 2,95 ·10-7.
666. Произведение растворимости сульфида магния равно 2 · 10-15. Выпадет ли осадок сульфида магния, если смешать равные объёмы 0,004 н раствора нитрата магния и 0,0006 н раствора сульфида натрия (α =1)?
Ответ: осадок образуется.
667. Сколько воды потребуется для растворения 1 г СаС2О4 при комнатной температуре, если его ПР = 2,6 · 10-9?
Ответ: 153 л.
668. Образование малорастворимых соединений используют в гидрометаллургии при выделении веществ из растворов. Величина произведения растворимости характеризует полноту выделения вещества в осадок. Вычислите концентрацию ионов Mg2+ в насыщенном растворе Mg(OH)2, если ПР данного основания равно 3,2 × 10-11.
Ответ: 2 · 10-4 моль/л.
669. Найдите произведение растворимости Со(ОН)2, если растворимость вещества равна 0,4 ·10-5 моль/л.
Ответ: 2 ·10-16 моль/л.
670. В гидрометаллургии и аналитической практике в целях более полного выделения соединения из раствора используют избыток осадителя. Вычислите концентрацию ионов Ca2+ в насыщенном растворе карбоната кальция, если ПР(СаСО3) =
= 4,8 ×10-9, а концентрация осадителя равна 0,01 моль/л.
Ответ: 4,8 ·10-7 моль/л.
671. Почему при действии сероводородом на раствор двухвалентного железа осадок FeS не выпадает, а при действии сернистым аммонием – выпадает? Ответ поясните.
672. Почему осадок Mg(OH)2 растворяется в кислотах и в растворах аммонийных солей? Ответ поясните.
673. Почему сульфид двухвалентного марганца растворяется в разбавленной серной кислоте, а сульфид меди (II) – нет, если ПР(MnS) = 1,4 ×10-15, а ПР(CuS) = 4 ×10-38? Ответ поясните, пользуясь величинами произведения растворимости.
674. Учитывая величины произведения растворимости веществ, укажите, в каком направлении протекает реакция
BaCO3 + Na2SO4 Û BaSO4 + Na2CO3?
675. Учитывая величины произведения растворимости веществ, укажите, в каком направлении протекает реакция
CaCO3 + Na2SO4 Û CaSO4 + Na2CO3?
676. Напишите в ионно-молекулярной форме уравнения реакций нейтрализации.
а) HCl + Ba(OH)2; в) Fe(OH)3 + HNO3;
б) HF + KOH; г) CH3COOH + NH4OH.
Какие из этих реакций протекают обратимо, а какие необратимо?
677. Напишите в ионно-молекулярной форме уравнения реакций между:
а) КСN + HCl; б) NaCN + HNO3; в) Pb(NO3)2 + NaI.
678. Напишите в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ:
а) гидрокарбонат натрия и соляная кислота;
б) трёххлористое железо и гидроксид калия;
в) гидросульфид калия и гидроксид калия.
679. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) Be(ОН)2 и КОН; б) НNO3 и Cа(ОН)2; в) ZnOHNO3 и НNO3.
680. Напишите в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ:
а) нитрат серебра и хромат калия;
б) йодид калия и нитрат свинца (II);
в) сульфат кадмия и сульфид натрия.
681. Составьте уравнение гидролиза солей в молекулярном и молекулярно-ионном виде: K2SO3, Fe2(SO4)3, Al2S3, CH3COONa. Укажите рН среды для этих солей.
682. Какую реакцию среды будут иметь растворы приведенных солей? Подтвердите это соответствующими уравнениями гидролиза.
а) NaNO2; б) CoCl2; в) Ba(NO2)2.
683. При смешивании растворов Al(HSO4)3 и K2S в осадок выпадает Al(OH)3. Укажите причину этого и составьте соответствующие молекулярные и ионно-молекулярные уравнения.
684. Какую реакцию среды (кислую, щелочную или нейтральную) должны иметь растворы следующих солей: NH4CN, K2CO3, Al(NO3)3, ZnSO4, Li2S? Ответ подтвердите соответствующими молекулярными и молекулярно-ионными уравнениями.
685. Вычислите константу гидролиза хлорида аммония, определите степень гидролиза этой соли в 0,001 М растворе и рН раствора (К д = 1,77 · 10-5).
Ответ: К г = 5,65 · 10-10; h = 7,52 · 10-4; рН = 6,12.
686. Определите степень гидролиза и рН 0,005Н раствора KCN, если К д(KCN) = 4,9 · 10-10.
Ответ: h = 0,063; рН = 10,5.
687. Вычислите константу гидролиза, степень гидролиза и рН 0,02 М раствора СН3СООNa (К д = 1,8 · 10-5).
Ответ: К г = 5,56 · 10-10; h = 1,67 · 10-4; рН = 8,52.
688. Гидролиз раствора FeCl3 при нагревании идет ступенчато и заканчивается образованием осадка Fe(OH)3. Представьте уравнениями все три ступени этого процесса.
689. Составьте молекулярные и ионные уравнения гидролиза солей CaS, Na2SiO3, CrCl3, Fe2(SO4)3. Укажите рН среды (> 7, < 7 или = 7).
690. При смешивании растворов CrCl3 и (NH4)2S гидролиз обеих солей доходит до конца. Составьте ионные и молекулярные уравнения реакции гидролиза обеих солей при их смешивании.
691. В какую сторону сместится равновесие гидролиза KCN, если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнение гидролиза в молекулярном и ионном виде.
692. Водородный показатель 0,003 н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли.
Ответ: 1,06 ·10-2.
693. Рассчитайте константы гидролиза солей NH4CN, CH3COONH4, NH4ClO, если константы диссоциации NH4ОН, НCN, СН3СООН и НClO равны, соответственно, 1,77 · 10-5;
4,9 · 10-10; 1,75 · 10-5; 3,0 · 10-8.
Ответ: 1,15; 3,2 · 10-4; 0,019.
694. Рассчитайте рН 0,5 М раствора хлорида алюминия, учитывая только 1-ю ступень гидролиза (К д = 1,38 · 10-9).
Ответ: рН = 2,6.
695. Почему при введении в раствор FeCl3 раствора соды в осадок выпадает не карбонат железа, а его гидроксид? Напишите уравнения процессов.
696. Водный раствор цианида натрия применяют в металлургии золота и серебра. Как отразится на равновесии гидролиза цианида натрия прибавление:
а) раствора щелочи;
б) раствора кислоты;
в) NH4Cl?
697. Составьте молекулярные и ионные уравнения реакций, протекающих при нейтрализации раствором карбоната натрия растворов FeCl3, AlCl3, CrCl3, которые получают при солянокислом травлении металлов.
698. Какие вещества, получающиеся при переработке хлорированием лопаритового концентрата, подвергаются гидролизу: TiCl4, CaCl2, NbCl5, NaCl, SrCl2?
699. Укажите реакцию среды растворов, образующихся при разбавлении водой травильных растворов, содержащих Na3AlO3, Na2ZnO2, Na2SnO2.
700. Приведите по три примера солей, в водных растворах которых:
а) рН < 7;
б) рН > 7;
в) рН = 7.
Составьте сокращенно-ионные уравнения гидролиза этих солей.
Окислительно-восстановительные
реакции
701. Закончите уравнение реакции и расставьте коэффициенты. В каком направлении протекает реакция? Ответ подтвердите расчетами.
CuS + HNO3 → Cu(NO3)2 + H2SO4 + NO2 +….
702. Закончите уравнение реакции и расставьте коэффициенты. В каком направлении протекает реакция? Ответ подтвердите расчетами.
As2S3 + HNO3 → H3AsO4 + H2SO4 +….
703. По приведенным ниже электронно-ионным схемам реакций составьте уравнения окислительно-восстановительных реакций (в молекулярном виде).
а) Cr2O 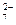 + 14H+ + 6e → 2Cr3+ + 7H2O
+ 14H+ + 6e → 2Cr3+ + 7H2O
H2O2 – 2 e → O2 + 2H+;
б) S0 + 8OH– – 6 e → SO 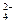 + 4H2O
+ 4H2O
ClO– + H2O + 2 e → Cl– + 2OH–.
704. Закончите уравнения реакций и расставьте коэффициенты, используя метод ионно-электронного баланса.
а) KBr + MnO2 + H2SO4 → Br2 + MnSO4 +…;
б) FeS + HNO3 → Fe(NO3)3 + NO2 + H2SO4 +….
705. По приведенным ниже электронно-ионным схемам реакций составьте уравнения окислительно-восстановительных реакций (в молекулярном виде).
а) 3S2– – 6 e → 3S0
Сr2O 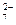 + 14H+ + 6 e → 2Cr3+ + 7H2O;
+ 14H+ + 6 e → 2Cr3+ + 7H2O;
б) 3Cu – 6 e → 3Cu2+
2NO 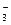 + 8H+ + 6 e → 2NO + 4H2O.
+ 8H+ + 6 e → 2NO + 4H2O.
706. Можно ли использовать перманганат калия в качестве окислителя в следующих процессах при стандартных условиях?
а) HNO2 + H2O – 2 e → NO 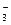 + 3H+;
+ 3H+;
б) 2H2O – 2 e → H2O2 + 2H+.
707. С помощью стандартных окислительно-восстанови-тельных потенциалов определите, возможно ли окисление Fe2+ в Fe3+ в щелочной среде с помощью хромата калия?
708. Чему равна концентрация ионов Н+ в растворе, если окислительно-восстановительный потенциал системы
Cr2O 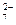 + 14H+ + 6 e → 2Cr3+ + 7H2O
+ 14H+ + 6 e → 2Cr3+ + 7H2O
равен 1,6 В, а концентрации ионов Cr2O 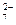 и Cr3+ равны, соответственно, 1 моль/л и 1×10-6 моль/л?
и Cr3+ равны, соответственно, 1 моль/л и 1×10-6 моль/л?
709. Вычислите окислительно-восстановительный потенциал для системы
MnO 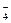 + 8H+ + 5 e → Mn2+ + 4H2O,
+ 8H+ + 5 e → Mn2+ + 4H2O,
если Е °(MnO 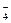 / Mn2+) = 1,51 В; С (MnO
/ Mn2+) = 1,51 В; С (MnO 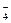 ) = 1×10- 5 моль/л; С (Mn2+) = 1×10‑2 моль/л; С (Н+) = 0,2 моль/л.
) = 1×10- 5 моль/л; С (Mn2+) = 1×10‑2 моль/л; С (Н+) = 0,2 моль/л.
710. Можно ли при стандартных условиях окислить хлорид водорода до Cl2 с помощью серной кислоты? Ответ подтвердите расчетом энергии Гиббса.
711. Закончите уравнения реакций и расставьте коэффициенты.
а) H2S + KMnO4 + HCl → S + …;
б) Na3AsO3 + KMnO4 + KOH → Na3AsO4 + ….
712. По приведенным ниже электронно-ионным схемам реакций составьте уравнения окислительно-восстановительных реакций (в молекулярном виде).
а) SO 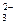 + H2O – 2 e → SO
+ H2O – 2 e → SO 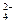 + 2H+
+ 2H+
MnO 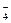 + 2H2O + 3 e → MnO2 + 4OH–;
+ 2H2O + 3 e → MnO2 + 4OH–;
б) CNS– + 4H2O – 6 e → SO 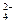 + HSN + 7H+
+ HSN + 7H+
H2O2 + 2 e → 2OH–.
713. Можно ли осуществить следующие реакции окисления фосфорной кислоты?
а) H3PO4 + I2 + H2O → …;
б) H3PO4 + Cd(NO3)2 + H2O → Cd + …;
в) H3PO4 + Hg(NO3)2 + H2O → Hg + ….
714. Можно ли с помощью нитрата железа (III) окислить HCl до Cl2?
715. Закончите уравнения реакций и расставьте коэффициенты. В каком направлении протекают реакции?
а) KMnO4 + H3PO3 + H2SO4 → MnSO4 + H3PO4 + …;
б) K2Cr2O7 + H2O2 + H2SO4 → ….
716. Напишите уравнения реакций взаимодействия между:
а) углеродом и азотной кислотой (при этом углерод окисляется до СО2, а азотная кислота восстанавливается до NO2);
б) йодидом водорода и перманганатом калия в сернокислой среде (при этом перманганат калия восстанавливается до сульфата марганца (II) и выделяется элементарный йод).
Для всех реакций составьте электронно-ионные схемы и подберите коэффициенты.
717. Определите молярную массу эквивалента перманганата калия как окислителя, если это вещество в процессе реакции восстанавливается:
а) до сульфата марганца (II);
б) до диоксида марганца;
в) до манганата калия.
718. Закончите уравнения реакций и расставьте коэффициенты. В каком направлении протекают реакции?
а) K2S + KMnO4 + H2O → S + …;
б) Nа2SeO3 + Cl2 + NaOH → Na2SeO4 + NaCl + ….
719. Вычислите ЭДС системы
Fe3+ + I– + H2O ↔ Fe2+ + IO 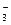 + H+.
+ H+.
Прямая или обратная реакция будет протекать в системе? Ответ мотивируйте (Е °(Fe3+/Fe2+) = +0,77 В, Е °(IO 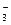 + 6Н+/ I– +
+ 6Н+/ I– +
+ 3H2O) = 1,09 В).
720. Будет ли протекать реакция между I– и Fe3+ с образованием свободного йода? Чему равна ЭДС реакции? Ответ мотивируйте.
721. Закончите составление уравнения окислительно-восста-новительной реакции
CrBr3 + H2O2 + … → Na2CrO4 + NaBr + H2O.
Расставьте коэффициенты, используя метод ионно-электрон-ного баланса.
722. Вычислите ЭДС системы
IO 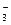 + SO
+ SO 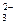 + H+ ↔ I2 + SO
+ H+ ↔ I2 + SO 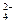 + H2O.
+ H2O.
Прямая или обратная реакция будет протекать в системе?
723. Вычислите молярные массы эквивалентов сульфата железа (II) в реакциях.
FeSO4 + Н2SO4 + Н2О2 → Fe2(SO4)3 + H2O;
FeSO4 + Br2 + H2SO4 → Fe2(SO4)3 + HBr.
724. Уравняйте ОВР, используя метод ионно-электронных уравнений. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя.
FeSO4 + KClO3 + H2SO4 = Fe2(SO4)3 + KCl + H2O.
725. Уравняйте реакцию методом ионно-электронного баланса. Укажите тип реакции, рассчитайте молярную массу эквивалента окислителя.
Mn(OH)2¯ + Cl2 + KOH ® MnO2 + KCl + H2O.
726. Уравняйте реакцию методом ионно-электронного баланса. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя.
MnO2¯ + О2 + KOH ® К2MnO4 + H2O.
727. Уравняйте реакцию методом ионно-электронного баланса и рассчитайте ЭДС.
FeSO4 + Br2 + H2SO4 ® Fe2(SO4)3 + HBr.
728. Уравняйте ОВР, используя метод ионно-электронных уравнений. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя.
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O.
729. Какие из ионов галогенов (F–, Cl–, Br–, I–) могут быть окислены до свободных галогенов двуокисью свинца (PbO2) в кислой среде? Для всех реакций составьте электронно-ионные схемы, подберите коэффициенты и рассчитайте стандартную ЭДС.
730. Выделение меди, кадмия и других металлов из сульфатных растворов от выщелачивания окиси цинка, содержащей примеси, осуществляется по реакциям:
CuSO4 + Zn = ZnSO4 + Cu;
CdSO4 + Zn = ZnSO4 + Cd;
NiSO4 + Zn = ZnSO4 + Ni;
FeSO4 + Zn = ZnSO4 + Fe.
Учитывая, что процесс выделения металлов при цементации цинком прекращается после достижения равенства скоростей прямого и обратного процессов (т.е. при Е = 0), вычислите предельно достижимое соотношение концентраций ионов цинка и примесных металлов.
Ответ: 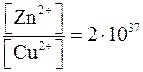 ;
; 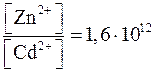 ;
; 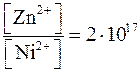 ;
; 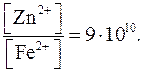
731. Окислительное рафинирование меди от примесей Fe, Ni, Co, Zn, Sb, Pb и Sn (содержание примесей одинаковое) осуществляют продувкой расплава черновой меди воздухом или кислородом. Вычислите ЭДС и D G  реакций образования оксидов перечисленных металлов по реакции
реакций образования оксидов перечисленных металлов по реакции
CuO + Me = MeO + Cu
и укажите очередность образования оксидов: FeO, NiO, CoO, ZnO, As2O3, Sb2O3, PbO и SnO2.
Ответ: для реакции CuO + Fe = FeO + Cu D G  = –113 кДж; Е 0 = 0,59 В; последовательность образования оксидов: ZnO, SnO2, FeO, Sb2O3, CoO, NiO, As2O3, PbO.
= –113 кДж; Е 0 = 0,59 В; последовательность образования оксидов: ZnO, SnO2, FeO, Sb2O3, CoO, NiO, As2O3, PbO.
732. Какие из ионов галогенов (F–, Cl–, Br–, I–) могут быть окислены до свободных галогенов азотистой кислотой (НNO2) в кислой среде? Для всех реакций составьте электронно-ионные схемы, подберите коэффициенты и рассчитайте стандартную ЭДС.
733. При очистке растворов титана от примеси железа восстанавливают Fe3+ до Fe2+ железным порошком по реакции
Fe + Fe3+ Û 2Fe2+.
При каком соотношении концентраций Fe2+ и Fe3+ начнется восстановление титана по реакции
2TiOSO4 + Fe + 2H2SO4 = Ti2(SO4)3 + FeSO4 + 2H2O?
Ответ: 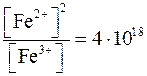 .
.
734. В какой среде можно осуществить превращение Cr3+ ® ® Cr2O  , если в качестве окислителя использовать:
, если в качестве окислителя использовать:
а) KMnO4;
б) H2O2?
Напишите уравнения реакций и уравняйте методом ионно-электронных уравнений.
735. Окислительное рафинирование железа от примесей С, Si, Mn и S (содержание примесей одинаковое) осуществляют продувкой расплава чугуна воздухом или кислородом. Вычислите ЭДС и D G  реакций образования оксидов перечисленных элементов по реакции
реакций образования оксидов перечисленных элементов по реакции
2FeO + Э = ЭO2 + 2Fe
и укажите очередность образования оксидов: СO2, SiO2, MnO2, SO2.
736. При обжиге сульфида сурьмы (III) образуется оксид сурьмы (III) и оксид серы (IV). Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
737. При взаимодействии оксида хрома (III) с кремнием в присутствии оксида кальция образуется металлический хром и силикат кальция. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
738. При взаимодействии йодоводородной и серной кислот образуется йод, сероводород и вода. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
739. При прокаливании сульфида цинка на воздухе образуются оксиды цинка и серы (IV). Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
740. По реакции оксида меди (II) с аммиаком образуются азот, медь и вода. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
741. Обработка сульфата железа (II) азотной и серной кислотами приводит к получению сульфата железа (III), оксида азота (II) и воды. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
742. По реакции между хроматом калия и соляной кислотой образовались хлорид хрома (III), хлор, хлорид калия и вода. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
743. Взаимодействие углерода с азотистой кислотой приводит к образованию диоксида углерода, монооксида азота и воды. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
744. Рассмотрите окислительные свойства перманганата калия в кислой, щелочной и нейтральной среде. В какой из указанных сред перманганат калия наилучший окислитель? Составьте уравнение реакции при взаимодействии перманганата калия с сульфитом калия в данной среде.
745. Может ли концентрированная азотная кислота при стандартных условиях окислить свинец до диоксида свинца? Ответ подтвердите расчетом энергии Гиббса.
746. Какой из окислителей – диоксид марганца, диоксид свинца или дихромат калия – является наиболее эффективным по отношению к хлороводородной кислоте при получении хлора? Составьте уравнения реакции.
747. Какой из окислителей – хромат или дихромат калия – является наиболее эффективным по отношению к бромоводороду при получении брома? Составьте уравнение реакции.
748. Можно ли окислить сульфат хрома (III) действием перманганата калия в кислой среде? Составьте уравнение реакции.
749. Могут ли одновременно существовать в растворе бромоводород и перманганат калия? Ответ подтвердите расчетами.
750. К раствору сульфида натрия добавлена азотная кислота. Жидкость мутнеет вследствие образования свободной серы. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
 2015-03-20
2015-03-20 6038
6038
