Ақуыздардың ерітіндісін концентрлі азот қышқылымен өңдесек ерітінді сары түске боялады. Осы ерітіндіге аммиак қоссақ сары түс сарғышқа айналады.
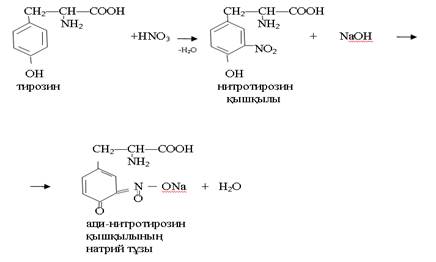
Аминдерді және аммиакты залалсыздандыру
Организмде жүретін декарбоксилдеу және дезаминтдеу процестері бойынша бөлініп шығатын аминдер мен аммиактар өте улы қосылыстар. Анаболистикалық реакцияларға қажет мөлшерлерінен артығы организмде әртүрлі реакциялар арқылы нейтралданады.
1. Аминдердің залалсыздандырылуы
Аминоксидоза ферменттің әсерінен амин карбон қышқылдарына дейін тотығады. Карбон қышқылдары β-тотығу процесі бойынша ацетил-СоА-ға дейін тотығады.
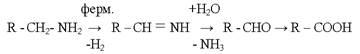
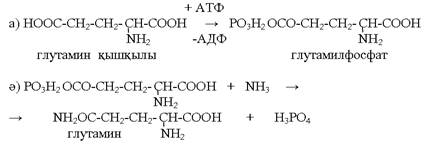
Аммиактың залалсыздандырылуы
Глутамин қышқылы (аспарагин) АТФ-тің қатысуымен фосфорленіп NH3-ті қосып алып глутамин (аспарагин) түзеді.
Бақылау сұрақтар:
1. Ақуыздардың жалпы сипаттамасы
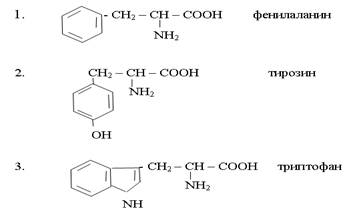
2. Триптофан аминқышқылын дезаминдеу реакциясы,
|
|
|
3. Метионин амин қышқылын декабоксилдеу реакциясы;
4. Аминдерді залалсыздандыру реакциясы
5. Аммиакты залалсыздандыру реакциясы
Дәріс №6
Тақырып: Ферменттер. Жалпы сипаттама
Жоспар:
1. Ферменттердің ашылу және зерттелу тарихы.
2. Ферменттердің қасиеттері.
Дәріс мақсаты: Ферменттер жайлы жалпы түсінік беру.
Дәріс мәтіні (қысқаша)
Ферменттер тірі клеткаларда пайда болатын және организмдегі биохимиялық процестерді жылдамдататын ақуыз тектес биологиялық катализаторлар. Олар организмдегі жекелеген химиялық процесстердің жүруін және бүкіл зат алмасу процесстерін тездетеді. Фермент деген терминді ғылымға 19-ғасырдың басында Я.Б.Ван Гельмонт деген химик енгізген. Бұл сөз латынның Ферментацио-газ бөле отырып ашу деген сөзінен шыққан. Сонымен бірге әдебиетте энзим деген сөз де қолданылады. (эн-ішінде, зиме-ашытқы) Ферменттерді зерттейтін ғылым саласын энзимология деп атайды.
Ферменттер клетканың тек белгілі бір аудандарында ғана шоғырланған, мысалы тыныс алу ферменттері митохондрияда, ақуыз синтезіне қатысты ферменттер рибосомада шоғырланған.
Ферменттер ақуыз тектес заттар болғандықтан ақуыздарды бөліп ал әдістерін ферменттерге де қолданылады. (Диализ, тұндыру, хроматография, электрофорез.)
Ферменттер — барлық тірі организмдер құрамына кіретін арнайы ақуыздар. Химиялық реакциялардьі жеделдетеді. Реакция түрлеріне сай ферменттер 6 топқа бөлінеді:
1. оксидоредуктазалар,
|
|
|
2. трансферазалар,
3. гидролазалар,
4. лиазалар,
5. изомеразалар,
6. лигазалар.
Ферменттер жасушаларда синтезделіп, биохимиялық реакцияларға қатысатын ақуыздық табиғаттағы биокатализатор болып табылады. Энзимология, ферментология – ферменттерді зерттейтін ғылым саласы. Ол басқа ғылымдармен: биология, генетика, фармакология, химиямен тығыз байланысты. Ферменттердің қызметі туралы алғашқы ғылыми еңбекті Кирхгофф (1814) жариялады. Кейін ашу үдерісі ашытқы клеткаларында ғана өтеді деген ұйғарым жасаған Л. Пастерге (1871), Либих ферменттер клеткалардың өмір сүруіндегі пайда болған өнім, ол клеткада да, олардан бөлек те қызмет атқарады деген қарсы пікір білдірді. Либихтің ғылыми көзқарасы М. Манассейна (1871), Бухнер (1897) зерттеулерінде эксперимент жүзінде дәлелденді. Клеткаларда синтезделген ферменттер өзіне тән арнайы қызметтерін организмнің барлық мүшелерінде атқарады. Ферменттік қасиет, негізінен глобулалық құрылымдағы ақуыздарға тән екені белгілі. Бірақ, қазіргі кезде кейбір фибриллалық ақуыздар да (актин, миозин) катализдік белсенділік көрсететіні анықталды.
Ферменттердің қасиеттері
Ферменттер өз әсерін өте аз мөлшерде катализаторға ұқсас жүргізеді. Фермент өзінің әсер етуші заты – субстратпен (S) ферменттік реакция жүргенде фермент-субстраттық кешен (аралық зат) түзеді. Бұл кешеннің қызметі өте күрделі, ол субстрат пен фермент молекулалары конформациясы мен энергиясын және химиялық байланыстарын өзгертеді. Реакция өткен соң фермент-субстраттық кешен жаңа қалыпқа ауысып, фермент-реакция өнімі кешеніне айналады. Содан кейін ол фермент және реакция өніміне (Р) жекеленіп бөлінеді: S + E → S·E → EP → E + P Ферменттердің катализдік ерекшелігіне келесі қасиеттері жатқызылады: а) Фермент өздігінен жаңа реакция жүргізбейді. Ол тек термодинамикалық мүмкін реакцияны ғана жүргізеді. Реакция барысында активтендіру энергиясы төмендейді. 2-суретте көрсетілгендей, реакцияның үлкен кедергі энергиясын сатылап бөліп, төмендету және активтендіру энергиясын жоғарлату арқылы реакция жылдамдығын жоғарлатады. б) Фермент басталған реакцияның бағытын өз бетінше өзгерте алмайды. Ол бір ғана реакция өнімі түзілуі бағытында жұмыс істейді. Мысалы, глюкокиназа глюкозадан тек глюкоза-6-фосфат түзілуін жүргізеді. в) Фермент қатысатын реакция қайтымды болса, ол реакцияны екі бағытта да жүргізе алады. Мысалы, көмірсулардың гликолиздік ыдырауына қатысатын фосфогексо-изомераза, альдолаза, фосфоглицерат-киназа, фосфоглицератлидаза және т.б.
Ферменттердің классификациясы. Ферменттердің саны бүрынғыдан әлдеқайда артып отырғандықтан, барлық ферменттерді ескі классификациямен қамту мүмкін болмай қалды. 1961 жылы көрнекті биохимик-ғалымдардан тұратын комиссия құрылды, бұл комиссия ферменттердің жаңа классификациясын жасап, оны Халықаралық биохимиялық Одақтың қарауына ұсынды. Жаңа классификация бойынша бізге белгілі ферменттердің барлығы алты класқа бөлінеді.
1. Оксидоредуктаза — тотығу-тотықсыздану ферменттері.
2.Трансфераза — атомдардың түрліше топтарының тасымалдау реакциясын катализдейтін ферменттер.
3.Гидролаза — заттардың түрліше топтарының гидролизіне қатысатын ферменттер.
4.Лиаза — еселенген байланыс түзе және оны бұза отырып, атомдар тобын қосып немесе ажыратып алу реакциясын катализдейтін ферменттер.
|
|
|
5. Изомераза — изомеризация реакциясын катализдейтін ферменттер.
6.Лигаза(синтетаза) АТР энергиясының есебінен жай заттардан күрделі органи-калық заттар түзу реакциясын катализдейтін ферменттер.
Жаңа классификация бойынша әрбір фермент атауының алдына төрт цифр қойылады. Бұл цифрлардың:
Біріншісі осы фермент негізгі алты кластың қайсысына жататындығын көрсетеді.
Екінші цифр оның класс тармағын білдіреді. Оксидоредуктаза ферментінде екінші цифр донор молекуласындағы тотығатын топтың табиғатын көрсетеді. Трансфераза ферментінде ол тасымалданатын топтық табиғатын көрсетеді. Гидролаза ферментінде екінші цифр гидролизденетін байланыстың типін, лиаза ферментінде — үзілетін байланыс типін, изомераза ферментінде — катализденетін изомеризация реакциясының типін, ал лигаза ферментінде — жаңадан түзілетін байланыс типін көрсетеді. Үшінші цифр класс тармағының түрін білдіреді. Оксидоредуктаза ферментінде ол реакцияға Қатысатын акцептордьщ типін белгілейді, трансфераза ферментінде — тасымалданатын топты, гидролаза ферментінде — гидролизденетін байланыстың типін, ал лиаза ферментінде — ыдыратылатын топты анықтайды. Изомераза ферментінде үшінші цифр субстраттың өзгеру сипатын, ал лигаза ферментінде түзілетін қосылыстың табиғатын көрсетеді. Сонымен, алғашқы үш цифр ферменттіқ типін нақты анықтайды, ал төртінші сан ферменттің осы; класс тармағындағы рет нөмірін білдіреді. Ферменттің шифрындағы әрбір цифр бір-бірінен нүктемен бөлінеді.
Ферменттер химиялық табиғаты жағынан – ақуыздық заттар. Ферменттердің тездеткіштік қасиеті оның молекуласында ақуыз барлығына байланысты.
Ферменттер де ақуыздар тәрізді қарапайым және күрделі болып екі топқа бөлінеді.
|
|
|
Қарапайым ферменттердің молекуласы тек қана ақуыздардан тұратын бір компонентті ғана болады. Бұларға жататындар- рибонуклеаза, пепсин, амилаза.
Күрделі ферменттердің молекуласы 2 компоненттен тұрады.Ақуыздық бөлігін апофермент ал ақуызсыз бөлігін кофермент деп атайды.
Биохимиялық реакцияларда коферменттер екі түрлі қызмет атқарады.
1) Ферменттің активті орталығын қалыптастырады.
2) Жекелеген атомдарды бір субстраттан екіншісіне тасымалдауға қатысады.
Бақылау сұрақтар:
1. Ферменттердің ағзада атқаратын ролі.
2. Ферменттердің каталитикалық қасиеттері
3. Ферменттерді бөлу процесінде денатурацияланудан сақтау.
4. Ферменттер номенклатурасы.
5. Ферменттер кластары.
Дәріс №7
Тақырып: Ферменттер. Ферменттердің әсер ету механизмі
Жоспар: 1. Ферменттердің субстраттармен әрекеттесу механизмі
Дәріс мақсаты: Ферменттердің әсер ету механизмдерін түсіндіру
Дәріс мәтіні (қысқаша):
Химиялық реакциялардың жылдамдығы реакцияға түсетін молекулалардың соқтығысу жиілігіне байланысты. Ал соқтығысу жиілігі молекулалардың концентрациясы мен ортаның температурасына байланысты.
Температураның артуына қарай молекулалар қозғалысының кинетикалық энергиясы да артады, бұл молекулалар соқтығысуы-ның жиілігіне әсер етеді. Сонымен қатар реакдияның өтуі үшін молекулалардың соқтығысуы жеткіліксіз. Бұл кезде олар активті күйде болуы қажет, басқаша айтқанда, оларда реакция үшін қажетті энергияның біршама артық қоры болуы тиіс. Мұндай энергияны активация энергиясы деп атайды.Фермент осы реакцияға қажет активацияэнергиясын кемітеді. Ол үшін фермент реакцияға ұшырайтын заттың молекуласымен (оны субстрат деп атайды) бірігіп комплекс түзеді. Комплексті қысқаша Ф + С (фермент + + субстрат) деп белгілейді. Бұл комплекстің түзілуіне әлдеқайда аз мөлшердегі энергия қажет.
Фермент + субстрат аралық комплексін түзу кезінде субстрат молекулалары біраз деформацияға ұшырайды, сондықтан реакцияның активация энергиясы кемиді. Бұл деформация субстраттың молекула ішілік байланыстарын әлсіретеді және молекуланы белгі-лі бір реакцияға неғұрлым қабілетті етіп шығарады. Комплекстің түзілуі спектрлік методтардың жәрдемімен дәлелденген.
Ф + С аралық комплексін түзуде субстрат ферменттің бүкіл молекуласымен емес, оның активтік орталықтар деп аталатын жеке-легең учаскелерімен қосылады. Ферменттің әрбір молекуласында 1—2 активтік орталық бар екендігі анықталып отыр.
Активтік орталықтық кеңістіктік құрылысы мен химиялық табиғаты белгілі бір субстратқа ғана сай келетіндей болып қалыптасқан. Бұл фермент басқа субстратқа катализатор бола алмайды. Осы ерекшелік ферменттердің талдаушылық қасиетін белгілейді.
Органикалық заттар мен ферменттердің структурасын зерттей келе,Э.Фишер фермент пен субстраттың кеңістіктік сәйкестігінің жақындығы женінде қорытынды шығарып, фермент субстратқа құлпының кілтіндей сәйкес келеді деп сипаттады.
Ферменттер молекулаларының құрылысына қарай екі топқа бөлінеді:
1) тек қана ақуыздардан тұратын бір компонентті ферменттер;
2) молекулаларының құрамына ақуыздан басқа активтік немесе простетикалық топ деп аталатын ақуызсыз текті заттар кіретін екі компонентті ферменттер.
Бір компонентті ферменттерде активтік орталықтың ролің амин қышқылдарының бүйірлік радикалдары атқарады. Ақуыз — фермент молекуласының II және III деңгейлік структурасы жасалған кезде, бүйірлік радикалдар өзара жақындасады да, активтік орталығын қүрады. Мысалы, панкреатикалық рибонуклеазаның активтік орталығына гистидин-16-ның, лизин- 41-дің және гистидин-119-дық қалдықтары кіреді. Активтік орталықтың осы компоненттері-нін. кеңістіктік жақындасуын күрделендіре түсетін амин қышқылдары да ферменттер үшін маңызды роль атқарады. Ақуыз — фермент молекуласының құрамынан басқа амин қышқылдарын ферменттің активтік қасиетіне нұқсан келтірмей де ажыратып алуға болады.
Бақылау сұрақтар:
1. Ферменттердің әсер ету механизмі.
2. Катализ туралы ұғым.
Дәріс №8
Тақырып: Коферменттер.
Жоспар:
1. Коферменттерге жалпы сипаттама.
2. Коферменттердің түрлері
3. Коферменттердің қызметі
Дәріс мақсаты: Коферменттер мен апоференттер арасыңдағы байланыс типтерін түсіндіру
Дәріс мәтіні (қысқаша):
Кофермент (Ко-бірге және фермент деген сөзден шыққан) – құрамына ақуыз жоқ органикалық қосылыстар, олар апоферментпен тығыз байланысқан. Ферменттің мықты байланысқан кофактор-простетикалық топ. Көптеген ферменттардің активтілігі үшін екі фактордың даметалл иондарының да, простетикалық топтың да (немесе коферменттің) болуы қажет. Оксидоредуктазаның құрамындағы флавинадениндинуклеотид (ФАД) осындай коферментке мысал бола алады.
Коферменттер төмен молекулалы заттар, олар жоғары температураға төзімді келеді және ферменттің ақуыздық бөлігінен оңай ажырайды. Мысалы, диализ кезінде осылай болады. Олар сөзсіз қажетті кофактор ретінде ферменттердің каталитикалық жұмысына қатысады.
Катализдік процесті фермент өзінің бүкіл молекуласымен жүзеге асырады. Оның ақуыздіқ бөлігі ферменттің талғампаздық қасиетін және реакцияның жылдамдығын анықтайды. Апофермент субстратты уақытша қосып алады, ал кофермент кезде оның өзгеруін қамтиды. Ал бір кофактор дың өзі бірнеше ферменттің құрамды бөлігі болуы мүмкін. Мысалы фосфопиридоксаль 30-дан астам ферменттің кофакторы болып келеді.
Көптеген ферменттер витаминге жатады немесе витаминдер туындысы болып табылады. Коферменттерге белсенді тобы бар витаминде – тиаминопирофосфат В1 витаминнің туындысы), никотинамидті коферменттер (РР витамині бар) жатады. В2, В6, В12 витаминдері және басқа да витаминдер кіреді. Сондықтан витаминнің жеткіліксіз болуы коферменттің түзілуі тежеледі. Осыдан кейін зат алмасу бұзылады және адам мен жануарлар ағзалары бірқалыпты тіршілік ете алмкйды. Витаминдік емес коферменттер де бар, мысалы, металлпорфириндер (цитохромдағы гемдер), нуклеотидтер (УДФ-глюкоза), пепдиттер (глутатион), т.б. коферменттер. Мұндай коферменттер зат алмасудың аралық өнімдерінен түзіледі және әрқашан да ағзадаболады.
Биохимиялық реакцияларда коферменттер екі түрлі қызмет атқарады:
1. Күрделі фермент құрамында субстраттың (субстрат дегеніміз фермент әсер ететін зат) катализдің өнделіп өзгеруіне қатысады, бұл кезде кофермент оның активті ортасына енеді
2. Бір субстраттан екінші субстратқа (немесе басқа ферментке) электрондарды протондарды немесе жеке химиялық топтарды тасымалдайды.
Коферменттер, коэнзимдер – фермент құрамындағы кіші молекулалы органикалық қосылыстар. Ферменттің ақуыз бөлігіне (апофермент) қарағанда кофермент қыздыруға төзімді және апоферменттен ажыратып алуға болады. Коферменттер организмде түрлі химиялық заттарды (ацильді, фосфатты, аминды т.б.), сутек көмірқышқыл газы т.б. тасымалдайды. Коферменттің апоферментпен байланысына қарай оларды одан жеңіл ажырайтын, жеңіл ажырамайтын не тіпті ажырамайтын түрлерге бөледі. Ерігіш ферменттердің коферменті жеңіл ажырайды, ал клетка структурасындағы ферменттер коферментпен ковалентті тығыз байланыста болады. Жеңіл бөлінетін коферментке сутек тасымалдайтын никотинамидадениндинуклеотид (НАД), никотинамидадениндинуклеотидфосфат (НАДФ), липой, аскорбин қышқылы, хинон т.б. жатады. Тығыз байланысты топтарға сутекті – флавин, амин тобы – пиридоксальфосфат, СО2-ні – биотин тасымалдайды. Коферменттің көбі витаминде, мысалы, НАД, НАДФ, кофермент А. Организмде витаминдер жеткіліксіз болса зат алмасу баяулайды.
 2015-03-20
2015-03-20 7316
7316








