Большинство реакций, используемых в аналитической химии, проводится в растворах. В соответствии с теорией электролитической диссоциации электролиты в растворах распадаются (диссоциируют) на положительно и отрицательно заряженные ионы вследствие взаимодействия с молекулами растворителя. Положительно заряженные ионы называют катионами (ионы водорода, металлов). Отрицательно заряженные ионы называются анионами (ионы кислотных остатков, гидроксид-ионы).
Процесс электролитической диссоциации изображают химическими уравнениями, например:
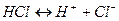
 2015-03-20
2015-03-20 2577
2577








