В нашем организме ферменты катализируют самые разнообразные реакции:
- реакции внешнего обмена (ферменты пищеварения) и внутриклеточные реакции (ферменты специфического и общего обмена)
- передачу сигнала (аденилаткиназа)
- процесс тканевого дыхания
- мышечное сокращение (миозинкиназа, миоаденилаткиназа)
- свёртываемость крови (фибриноген, протромбиназа,..)
+ +
- транспорт веществ (К – Nа - АТФаза)
- обезвреживание токсинов и чужеродных соединений (цитохром Р450)
- нейротрансмиссию – передачу нервного сигнала.
Часто ферменты являются объединёнными в комплексы (например, пируватдегидрогеназный). Необходимо знать, и о существовании изоферментов- ферментов, катализирующих одни и те же химические реакции в различных органах. Их появление обусловлено мутациями и естественным отбором. Изучение изоферментного состояния крови используется в медицине при диагностике, т.е. при повреждении определённых органов ферменты из них выходят в кровь, и, обнаружив в крови определённый фермент, можно сказать какой орган повреждён (см. таблицу). Также используют тот факт, что специфичным для органа является и соотношение разных ферментов и изоферментов.
Применение ферментов в медицине
| Основные разделы | Ферменты | Примеры использования |
| Диагностика | Лактатдегидрогеназа (изофермент ЛДГ-1) | Инфаркт миокарда. |
| Аспартатаминотрансфераза (АСТ) | Инфаркт миокарда. | |
| Аланинаминотрансфераза (АЛТ) | Заболевания печени (например, инфекционный гепатит). | |
| Креатинкиназа (изофермент ММ – мышечный тип, изофермент МВ – сердечный тип) | Прогрессирующая дистрофия. Инфаркт миокарда. | |
| Кислая фосфатаза (КФ) | Рак предстательной железы. | |
 - Амилаза - Амилаза | Заболевания поджелудочной железы. | |
| Лечение | Пепсин | Нарушение переваривания белков в желудке, нарушение синтеза или секреции пепсина. |
| Трипсин, химотрипсин | Лечение гнойных ран. | |
| Стрептокиназа, урокиназа | Предотвращение тромбообразования при пересадке органов и других операциях. | |
| Гиалуронидаза | Рассасывание рубцов. | |
| Аспарагиназа | Лечение некоторых злокачественных образований. | |
| Нуклеазы (ДНКаза) | Вирусный конъюнктивит, ринит, гнойный бронхит. | |
| Уреаза | Удаление мочевины из организма в аппаратах «искусственная почка». | |
| Использование ферментов в качестве аналитических реактивов | Глюкозооксидаза | Определение концентрации глюкозы в крови. |
| Холестеролоксидаза | Определение холестерина в крови. | |
| Липаза | Определение триацилглицеринов в крови. | |
| Уреаза | Определение мочевины в крови. |
 Снижение * стереохимич. специфичность - катализ только определённого
Снижение * стереохимич. специфичность - катализ только определённого
специфичности стереоизомера (например, D-, L-АК).
действия * абсолютная субстратная - катализ только одного субстрата (уреаза
фермента. ферментирует только мочевину).
* абсолютная групповая - катализ определённого класса веществ (алкогольдегидрогеназа)
* относит. групповая каталитич. действия на опред. связи в молекулах (липазы, протеазы)
* относится субстратн. – катализ субстратов, принадлежащих к
разным группам химических соединений (цитохром Р450)
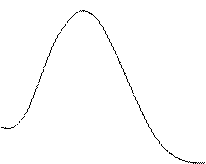
По константе Михаэлиса (Км) определяют сродство фермента к субстрату, чем меньше её значение, тем больше сродство Е к S.
Скорость ферментативной реакции максимальна при полном насыщении активных центров фермента субстратом.
Км. – это такое количество субстрата, при котором достигается половина максимальной скорости реакции.

 U U
U U




___ _
| |

 | |
| |
Км1 [S] Км2 [S]
Км2 < Км1 => второй график показывает большее сродство фермента к S, т.е. при меньшей концентрации S наблюдаем ту же скорость.
Е1 – энергия активации реакции без фермента

 Е2 – энергия активации ферментативной реакции.
Е2 – энергия активации ферментативной реакции.
Любая реакция протекает только потому,
 Е1 что выделяется энергия (энергия Гиббса G), но во
Е1 что выделяется энергия (энергия Гиббса G), но во
многих реакциях, для того, чтобы молекулы.
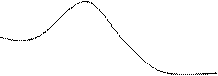 провзаимодействовали, нужно преодолеть барьер,
провзаимодействовали, нужно преодолеть барьер,
Е2 добавить Е извне. Использование фермента
 понижает энергетический барьер активации.
понижает энергетический барьер активации.
 G энергия активации - Е, необходимая для
G энергия активации - Е, необходимая для
 активное состояние при данной температуре.
активное состояние при данной температуре.

| Класс | Реакции | Основные подклассы, группы |
| Оксидоредуктазы | Окислительно-восстановительные реакции А +В àА +В восст окис окис восст | Дегидрогеназы, оксидазы, редуктазы, гидроксилазы. |
| Трансферазы | Перенос групп А – В + С à А + В - С | Киназы (фосфатные группы), трансаминазы (аминогруппы). |
| Гидролазы | Гидролиз связей (эфирных, пептидных, гликозидных, связей С-С, P-N) А – В + Н2О à А – Н + В - ОН | Эстеразы, фосфатазы, протеазы, липазы, нуклеазы, тиолазы. |
| Лиазы | Разрыв связей С-С, С-О, С- N, С-S путём элиминирования молекулы с образованием двойных связей. В обратной реакции ускоряют присоединение воды, аммиака и т.д. по двойной связи А (ХН) - В à А – Х + В - Н | Альдегидлиазы (альдолаза), углерод- кислородлиазы (фумараза), дегидратазы (енолаза), декарбоксилазы. |
| Изомеразы | Взаимопревращение изомеров А ßà Изо - А | Изомеразы, мутазы. |
| Лигазы | Соединение 2 молекул, сопряжённое с гидролизом АТР А + В + АТР à А – В + АDР + Рi | Карбоксилазы, синтетазы. |
 2015-03-07
2015-03-07 827
827








