Современная металлургия получает более 75 металлов и многочисленные сплавы на их основе. В зависимости от способов получения металлов различают пиро-, гидро- и электрометаллургию.
Пирометаллургия охватывает способы получения металлов из руд с помощью восстановления, проводимые при высоких температурах. В тех случаях, когда руда является сульфидом металла, ее предварительно переводят в оксид путем окислительного обжига:
2ZnS + 3O2 = 2ZnO + 2SO2
и оксид восстанавливают, используя в качестве восстановителей уголь, активные металлы, оксид углерода (II), водород:
ZnO + C = Zn + CO
Fe2O3 + 3CO = 2Fe + 3CO2
CuO + H2 = Cu + H2O
Для того чтобы определить, какие реакции протекают самопроизвольно при данных условиях, можно использовать термодинамические данные. Они также могут помочь при выборе наиболее экономичного восстановителя и оптимальных условиях проведения реакции. Термодинамическим критерием самопроизвольного протекания реакции при постоянных температуре и давлении является отрицательная величина энергии Гиббса реакции и взаимосвязь с константой равновесия G0r = - RTlnK.
Отрицательному значению энергии Гиббса соответствует К >1.
В промышленных процессах равновесие достигается редко и можно осуществить процесс, когда константа равновесия меньше 1, если продукты реакции удаляются из реакционной зоны. При рассмотрении вопроса о практической осуществимости реакции следует учитывать скорости реакций. Но при высокой температуре реакции, как правило, протекают быстро, и с большей вероятностью идет термодинамически более благоприятная реакция.
Изучая тему «Термодинамика химических процессов», вы знакомились с диаграммой Эллингхема, которая обобщает температурные зависимости стандартных энергий Гиббса образования оксидов металлов и, значит, может быть использована для определения температуры, при которой восстановление углеродом С или монооксидом углерода СО протекает самопроизвольно.
Изломы на кривых диаграммы Эллингхема, когда наклон прямой окисления металла изменяется, означают, что металл претерпевает фазовое превращение, в частности плавится, и происходит изменение энтропии реакции.
Пользуясь этой диаграммой, можно сравнивать восстановительную активность простых веществ, анализировать влияние температуры на восстановительную активность простых веществ, сравнивать устойчивость оксидов, предсказывать направление окислительно-восстановительных реакций между простым веществом одного элемента и оксидом другого элемента.
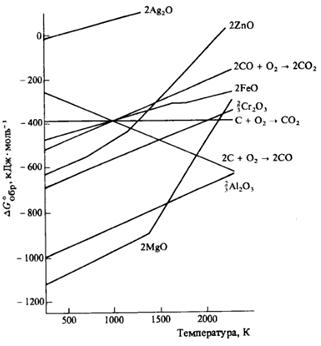
Пример. Используя данные этого рисунка расположите оксиды в ряд по увеличению их устойчивости при температуре 298 К.
Решение: оксид тем устойчивее, чем отрицательнее значение его энергии Гиббса образования. Наиболее устойчивый оксид магния MgO, наименее устойчив оксид серебра Ag2O. Устойчивость оксидов при 298 К возрастает в следующей последовательности:
Ag2O < CO < FeO < ZnO < Cr2O3 < Al2O3 < MgO
Пример. Расположите металлы и углерод в ряд по увеличению их активности взаимодействия с кислородом.
Решение: наиболее активен магний, наименее активно серебро:
Ag < C < Fe < Zn< Cr < Al < Mg
Общий вывод: химическая активность простого вещества тем выше, чем устойчивее его оксид.
Пример. Какова минимальная температура, при которой углерод может восстанавливать оксид цинка до металлического цинка? Какая суммарная реакция протекает при этой температуре?
Решение: как видно из диаграммы, линия, отвечающая реакции 2С + О2 = 2СО находится ниже линии 2Zn + O2 = 2ZnO при температурах выше приблизительно 950оС; следовательно, выше этой температуры восстановление оксида цинка углеродом протекает самопроизвольно. Аналогичная закономерность наблюдается и для оксидов железа и хрома.
 2015-04-12
2015-04-12 1122
1122








