Некоторые реакции протекают практически мгновенно, например, взрыв черного пороха, представляющего собой смесь угля, серы и селитры:
3C + S + 2KNO3 = N2↑+ 3CO2↑+ K2S.
Скорость химической реакции служит количественной мерой интенсивности ее протекания.
В общем случае под скоростью химической реакции понимают число элементарных актов реакции, происходящих в единицу времени в единице реакционного пространства.
Так как для гомогенных процессов реакционным пространством является объем реакционного сосуда, то
для гомогенных реакций с корость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Учитывая, что количество вещества, содержащееся в определенном объеме, характеризует концентрацию вещества, то
скорость реакции - это величина, показывающая изменение молярной концентрации одного из веществ в единицу времени.
Если при неизменных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с 1 до с 2 за промежуток времени от t 1 до t 2, то, в соответствии с определением, скорость реакции за данный промежуток времени (средняя скорость реакции) равна:
|
|
|
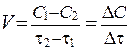 .
.
Обычно для гомогенных реакций размерность скорости V [моль/л·с].
Так как для гетерогенных реакций реакционным пространством является поверхность, на которой протекает реакция, то для гетерогенных химических реакций скорость реакции относится к единице площади поверхности, на которой протекает реакция. Соответственно, средняя скорость гетерогенной реакции имеет вид:
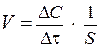 ,
,
где S - площадь поверхности, на которой протекает реакция.
Размерность скорости для гетерогенных реакций - [моль/л·с·м2].
Скорость химической реакции зависит от целого ряда факторов:
• природы реагирующих веществ;
• концентрации реагирующих веществ;
• давления (для газовых систем);
• температуры системы;
• площади поверхности (для гетерогенных систем);
• наличия в системе катализатора и других факторов.
Так как каждое химическое взаимодействие является результатом столкновения частиц, то увеличение концентрации (числа частиц в заданном объеме) приводит к более частым их столкновениям, и как следствие, к увеличению скорости реакции. Зависимость скорости химических реакций от молярных концентраций реагирующих веществ описывается основным законом химической кинетики - законом действующих масс, который был сформулирован в 1865 году Н.Н.Бекетовым и в 1867 году К.М.Гульдбергом и П. Вааге.
Закон действующих масс гласит: скорость элементарной химической реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ в степенях, равных их стехиоме-трическим коэффициентам.
|
|
|
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции.
Следует отметить, что закон действующих масс в полной мере применим лишь только к простейшим гомогенным реакциям. Если реакция протекает в несколько стадий, то закон справедлив для каждой из стадий, а скорость сложного химического процесса определяется скоростью наиболее медленно протекающей реакции, являющейся лимитирующей стадией всего процесса.
В общем случае, если в элементарную реакцию вступают одновременно т молекул вещества А и n молекул вещества В:
mА + nВ = С,
то уравнение для скорости реакции (кинетическое уравнение) имеет вид:
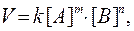
где k - коэффициент пропорциональности, который называется константой скорости химической реакции; [ А ] - молярная концентрация вещества А; [ B ] - молярная концентрация вещества B; m и n - стехиометрические коэффициенты в уравнении реакции.
Чтобы понять физический смысл константы скорости реакции, надо принять в написанных выше уравнениях концентрации реагирующих веществ [ А ] = 1 моль/л и [ В ] = 1 моль/л (либо приравнять единице их произведение), и тогда:
V = k
Отсюда ясно, что константа скорости реакции k численно равна скорости реакции, в которой концентрации реагирующих веществ (или их произведение в кинетических уравнениях) равны единице.
Константа скорости реакции k зависит от природы реагирующих веществ и температуры, но не зависит от значения концентрации реагентов.
Для гетерогенных реакций концентрация твердой фазы в выражение для скорости химической реакции не включается.
Например, в реакции синтеза метана:
С(т)+2H2(г)  CH4(г),
CH4(г),
согласно закону действующих масс, скорость реакции определяется только концентрацией водорода, а площадь поверхности твердого углерода учитывается константой скорости химической реакции k. Кинетическое уравнение для этой реакции будет имеет вид:
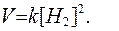
Если реакция протекает в газовой фазе, то существенное влияние на ее скорость оказывает изменение давления в системе, так как изменение давления в газовой фазе приводит к пропорциональному изменению концентрации. Так, увеличение давления приводит к пропорциональному росту концентрации, а уменьшение давления, соответственно, снижает концентрацию газообразного реагирующего вещества.
Изменение давления практически не влияет на концентрацию жидких и твердых веществ (конденсированное состояние вещества) и не оказывает влияния на скорость реакций, протекающих в жидкой или твердой фазах.
Химические реакции осуществляется за счет соударения частиц реагирующих веществ. Однако, далеко не всякое столкновение частиц реагентов является эффективным, т.е. ведет к образованию продуктов реакции. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и увеличивается число активных, следовательно, возрастает скорость химических процессов.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в два - четыре раза.
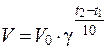 , где:
, где:
V 1 – скорость реакции при начальной температуре системы t 1, V 2 – скорость реакции при конечной температуре системы t 2,
γ – температурный коэффициент реакции (коэффициент Вант-Гоффа), равный 2÷4.
Знание величины температурного коэффициента γ дает возможность рассчитать изменение скорости реакции при увеличении температуры от Т 1 до Т 2. В этом случае можно использовать формулу:
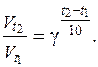
|
|
|
Очевидно, что при повышении температуры в арифметической прогрессии скорость реакции возрастает в геометрической прогрессии. Влияние температуры на скорость реакции тем значительнее, чем больше значение температурного коэффициента реакции g.
Следует заметить, что правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния небольших изменений температуры на скорость реакции.
Энергия, необходимая для протекания реакций, может быть обеспечена различными воздействиями (теплота, свет, электрический ток, лазерное излучение, плазма, радиоактивное излучение, высокое давление и т.д.).
Реакции могут подразделяться на тепловые, фотохимические, электрохимические, радиационно-химические и др. При всех этих воздействиях растет доля активных молекул, которые имеют энергию, равную или большую минимально необходимой для данного взаимодействия энергии Емин.
При столкновении активных молекул вначале образуется так называемый активированный комплекс, внутри которого и происходит перераспределение атомов.
Энергия, необходимая для увеличения средней энергии молекул реагирующих веществ до энергии активированного комплекса, называется энергией активации Еа.
Энергию активации можно рассматривать как некую дополнительную энергию, которую должны приобрести молекулы реагентов, чтобы преодолеть определенный энергетический барьер. Таким образом, Еа ра вна разности между средней энергией реагирующих частиц E исх и энергией активированного комплекса E мин. Энергия активации определяется природой реагентов. Значение Еа колеблется в пределах от 0 до 400 кДж. Если значение Еа превышает 150 кДж, то такие реакции при температурах, близких к стандартной, практически не протекают.
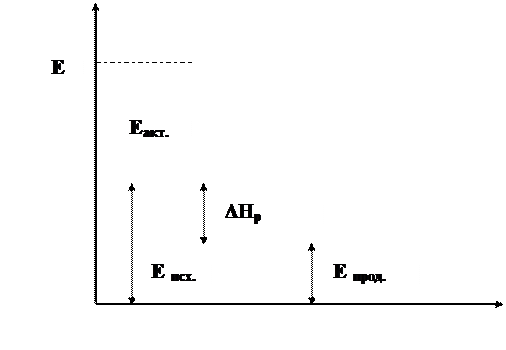
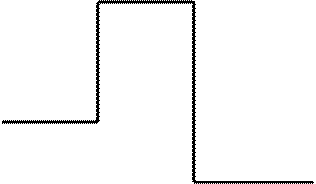
Изменение энергии системы в ходе реакции может быть графически представлено с помощью следующей энергетической диаграммы (рис. 6.1).
|
|






Рис. 6.1. Энергетическая диаграмма экзотермической реакции:
Eисх – средняя энергия исходных веществ;Eпрод – средняя энергия продуктов реакции;Eмин – энергия активированного комплекса;Eакт – энергия активации; ΔHр – тепловой эффект химической реакции
|
|
|
Из энергетической диаграммы видно, что разность между величинами энергии продуктов реакции и энергии исходных веществ, будет представлять из себя тепловой эффект реакции.
Епрод. – Еисх. = ΔНр.
Согласно уравнению Аррениуса, чем больше значение энергии активации E акт, тем в большей степени константа скорости химической реакции k зависит от температуры:
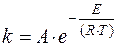 , где:
, где:
Е - энергия активации (Дж/моль),
R - универсальная газовая постоянная,
T - температура в К,
А - константа Аррениуса,
e = 2,718 - основание натуральных логарифмов.
Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции. Влияние, оказываемое катализаторами на химические реакции, называется катализом.
Например, смесь порошка алюминия и кристаллического йода при комнатной температуре не обнаруживает заметных признаков взаимодействия, но достаточно капли воды, чтобы вызвать бурную реакцию:
2Al + 3I2 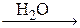 2AlI3.
2AlI3.
Различают гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь) и гетерогенныйкатализ (катализатор и реагирующие вещества находятся в разных фазах и каталитический процесс идет на поверхности раздела фаз).
Для объяснения механизма гомогенного катализа наибольшее распространение получила теория промежуточных соединений (предложена французским исследователем Сабатье и развита в работах русского ученого Н.Д. Зелинского). Согласно этой теории медленно протекающий процесс, например, реакция:
A + B = AB
в присутствии катализатора протекает быстро, но в две стадии. В первой стадии процесса образуется промежуточное соединение одного из реагентов с катализатором A… kat.
Первая стадия:
A + kat = A.∙. kat.
Полученное соединение на второй стадии образует с другим реагентом активированный комплекс [ A.∙.kat.∙.B ], который превращается в конечный продукт AB с регенерацией катализатора kat.
Вторая стадия:
A.∙.kat + B = [A.∙. kat.∙. B] = AB + kat.
Промежуточное взаимодействие катализатора с реагентами, направляет процесс на новый путь, характеризующийся более низким энергетическим барьером. Таким образом, механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений.
Примером может служить медленно протекающая реакция:
2SO2 + O2 = 2SO3 медленно.
При промышленном нитрозном способе получения серной кислоты в качестве катализатора используется оксид азота (II), что значительно ускоряет реакцию:
2SO2 +O2 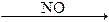 2SO3 быстро.
2SO3 быстро.
В присутствии катализатора (NO) реакция протекает быстро в две стадии:
O2 + 2NO = 2NO2 быстро,
2NO2 + 2SO2 = 2SO3 + 2NO быстро.
Гомогенными катализаторами часто служат растворы кислот, оснований и солей (прежде всего солей d -элементов: Cr, Mn, Fe, Co, Ni, Cu и др.).
В случае гетерогенного катализа реагенты и катализатор образуют несколько фаз. Реакции протекают на границе раздела фаз: обычно на поверхности раздела между твердой и жидкой или твердой и газовой фазами.
Например, синтез аммиака из азота и водорода осуществляют с помощью катализатора, представляющего собой смесь металлического железа с добавками оксида калия и алюминия.
N2 + 3H2 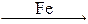 2NH3.
2NH3.
Широко используется гетерогенный катализ в процессах нефтепереработки. Катализаторами служат платина, никель, оксид алюминия и др. Гидрирование растительного масла протекает на никелевом катализаторе (никель на кизельгуре) и т.д.
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты контактным методом.
Вещества, повышающие активность катализатора называют промоторами (или активаторами). При этом, промоторы могут сами и не обладать каталитическими свойствами.
Каталитические яды - посторонние примеси в реакционной смеси, приводящие к частичной или полной потере активности катализатора. Так, следы фосфора и мышьяка вызывают быструю потерю катализатором V2O5 активности в реакции окисления SO2 в SO3.
Многие важнейшие химические производства, такие как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
Биохимические реакции в растительных и животных организмах ускоряются биохимическими катализаторами - ферментами.
Резко замедлить протекание нежелательных химических процессов можно при добавлении в реакционную среду специальных веществ - ингибиторов. Например, для торможения нежелательных процессов коррозионного разрушения металлов широко используются различные ингибиторы коррозии металлов.
Вопросы для самоконтроля знаний теории
 2015-04-12
2015-04-12 692
692








